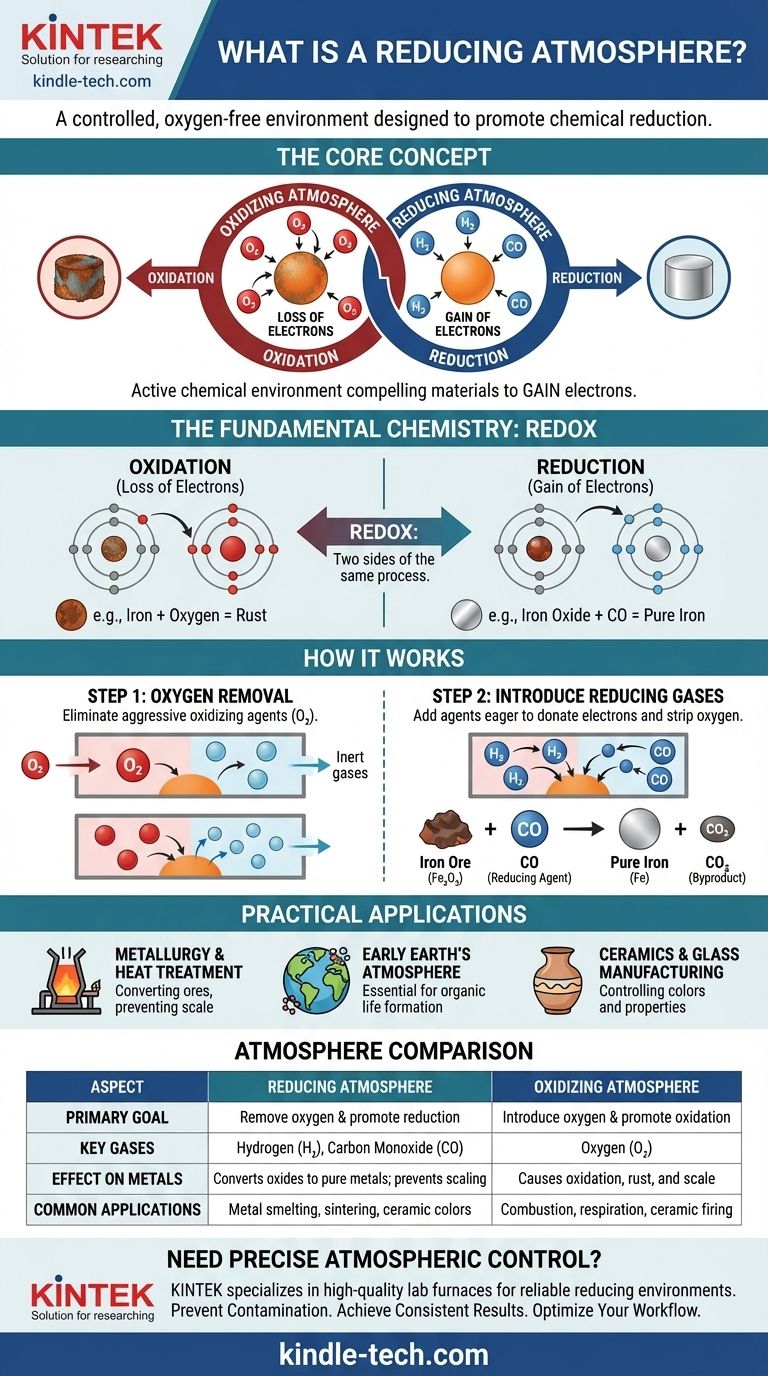
In breve, un'atmosfera riducente è un ambiente gassoso controllato in cui l'ossigeno è stato intenzionalmente rimosso e sostituito con gas che prevengono l'ossidazione e promuovono attivamente la riduzione chimica. Questo tipo di atmosfera è ricca di "agenti riducenti" come idrogeno (H₂), monossido di carbonio (CO) o idrogeno solforato (H₂S), che sono chimicamente desiderosi di donare elettroni e sottrarre ossigeno da altri materiali.
Un'atmosfera riducente non riguarda semplicemente l'assenza di ossigeno; è un ambiente chimico attivo progettato per forzare una reazione specifica. Funziona creando un surplus di elettroni, costringendo i materiali al suo interno ad acquisire quegli elettroni e a tornare a uno stato meno ossidato.

La chimica fondamentale in gioco
Per comprendere veramente un'atmosfera riducente, devi prima capire il principio chimico fondamentale su cui si basa: ossidazione e riduzione. Queste sono due facce della stessa medaglia, un processo spesso chiamato "redox".
Comprendere l'ossidazione e la riduzione
L'ossidazione è la perdita di elettroni. Un esempio classico è la ruggine del ferro. L'ossigeno nell'aria sottrae elettroni dagli atomi di ferro, formando ossido di ferro (ruggine). Il ferro viene "ossidato".
La riduzione è l'acquisizione di elettroni. È l'opposto chimico dell'ossidazione. Un'atmosfera riducente facilita questo processo creando un ambiente in cui gli atomi sono costretti ad assumere elettroni.
Pensala come una lotta chimica per gli elettroni. Un agente ossidante, come l'ossigeno, è forte e sottrae elettroni da altri materiali. Un agente riducente, come l'idrogeno, è generoso e dona elettroni a altri materiali.
Il ruolo della rimozione dell'ossigeno
Il primo e più critico passo nella creazione di un'atmosfera riducente è la rimozione dell'ossigeno libero (O₂) e di altri gas ossidanti.
L'ossigeno è un agente ossidante altamente aggressivo. La sua presenza rende quasi impossibile eseguire una reazione di riduzione, poiché sottrarrà incessantemente elettroni da qualsiasi fonte disponibile. Rimuovendolo si impedisce che si verifichi questa ossidazione indesiderata.
La funzione dei gas riducenti
La semplice rimozione dell'ossigeno crea un'atmosfera neutra, o inerte. Per renderla un'atmosfera riducente, vengono introdotti gas specifici.
Questi gas, tipicamente idrogeno (H₂) o monossido di carbonio (CO), agiscono come potenti agenti riducenti. Hanno una maggiore affinità per l'ossigeno rispetto a molti altri elementi, il che significa che "rubano" attivamente atomi di ossigeno da composti come gli ossidi metallici.
Ad esempio, quando il minerale di ferro (ossido di ferro, Fe₂O₃) viene riscaldato in un forno con monossido di carbonio, il CO sottrae l'ossigeno dal ferro, lasciando ferro liquido puro e creando anidride carbonica (CO₂) come sottoprodotto. Il minerale di ferro è stato "ridotto" a ferro.
Applicazioni pratiche e contesto
Le atmosfere riducenti non sono solo un concetto teorico; sono uno strumento critico in molti processi industriali e scientifici in cui è necessario un controllo chimico preciso.
Metallurgia e trattamento termico
Questa è l'applicazione più comune. Gli altiforni utilizzano un'atmosfera riducente ricca di monossido di carbonio per trasformare i minerali metallici in metalli puri. Viene anche utilizzata nella ricottura e nella sinterizzazione per prevenire la formazione di ossidi (scaglia) sulla superficie dei metalli durante la lavorazione ad alta temperatura.
L'atmosfera della Terra primordiale
Gli scienziati teorizzano che l'atmosfera primordiale della Terra fosse riducente, contenente metano, ammoniaca e vapore acqueo ma praticamente nessun ossigeno libero. Questo ambiente era essenziale per la formazione delle complesse molecole organiche che alla fine hanno portato alla vita.
Produzione di ceramiche e vetro
L'atmosfera all'interno di un forno ha un profondo effetto sul prodotto finale. Un'atmosfera riducente può essere utilizzata per creare colori e proprietà specifiche nelle smalti ceramici e nel vetro modificando lo stato di ossidazione degli ossidi metallici utilizzati come coloranti. Ad esempio, l'ossido di rame produce verde in una cottura ossidante ma un rosso intenso in una riducente.
Comprendere i compromessi: ossidante vs. riducente
L'opposto di un'atmosfera riducente è un'atmosfera ossidante, che è ricca di ossigeno. L'attuale atmosfera del nostro pianeta ne è un ottimo esempio.
L'atmosfera ossidante
Un'atmosfera ossidante promuove la perdita di elettroni. È essenziale per processi come la combustione e la respirazione cellulare, ma è distruttiva in altri contesti, causando corrosione, deterioramento e degrado.
Perché il controllo atmosferico è critico
La scelta tra un'atmosfera riducente, inerte o ossidante è determinata interamente dal risultato desiderato. Usare quella sbagliata non è solo inefficiente; può essere catastrofico per un processo.
Tentare di fondere il metallo in un ambiente ricco di ossigeno fallirebbe, producendo invece più ossidi e scaglia. Al contrario, la cottura di una ceramica che richiede ossidazione in un'atmosfera riducente darebbe colori errati e imprevedibili.
Come applicare questa conoscenza
Comprendere lo scopo di un'atmosfera specifica si riduce all'identificazione della trasformazione chimica desiderata.
- Se l'obiettivo primario è prevenire il degrado: Si utilizza un'atmosfera inerte o riducente per rimuovere l'ossigeno, il principale agente di corrosione e ossidazione.
- Se l'obiettivo primario è trasformare un materiale da un ossido alla sua forma pura: È necessaria un'atmosfera riducente per sottrarre attivamente atomi di ossigeno dal materiale (ad esempio, trasformare il minerale in metallo).
- Se l'obiettivo primario è controllare le proprietà finali di un composto: L'equilibrio tra ossidazione e riduzione viene utilizzato per manipolare lo stato elettronico degli elementi, controllando così risultati come il colore nelle ceramiche o la conduttività nei semiconduttori.
In definitiva, sapere se un'atmosfera è progettata per donare o accettare elettroni è la chiave per prevedere e controllare i risultati chimici.
Tabella riassuntiva:
| Aspetto | Atmosfera Riducente | Atmosfera Ossidante |
|---|---|---|
| Obiettivo Primario | Rimuovere l'ossigeno e promuovere la riduzione (acquisizione di elettroni) | Introdurre ossigeno e promuovere l'ossidazione (perdita di elettroni) |
| Gas Chiave | Idrogeno (H₂), Monossido di Carbonio (CO) | Ossigeno (O₂) |
| Effetto sui Metalli | Converte gli ossidi metallici in metalli puri; previene la formazione di scaglia | Causa ossidazione, portando a ruggine e scaglia |
| Applicazioni Comuni | Fusione di metalli, ricottura, sinterizzazione, smalti ceramici specifici | Combustione, respirazione, cottura di alcune ceramiche |
Hai bisogno di un controllo atmosferico preciso per i tuoi processi di laboratorio?
Sia che tu stia sinterizzando metalli, sviluppando smalti ceramici specializzati o conducendo ricerche che richiedono un ambiente privo di ossigeno, l'attrezzatura giusta è fondamentale. KINTEK è specializzata nella fornitura di forni e reattori da laboratorio di alta qualità progettati per un controllo atmosferico preciso, inclusa la creazione di ambienti riducenti affidabili.
Ti aiutiamo a:
- Prevenire la contaminazione: Assicurati che i tuoi materiali non vengano degradati da ossidazioni indesiderate.
- Ottenere risultati coerenti: Ottieni le precise trasformazioni chimiche di cui hai bisogno, lotto dopo lotto.
- Ottimizzare il tuo flusso di lavoro: Con attrezzature progettate per affidabilità e facilità d'uso.
Pronto a migliorare le capacità del tuo laboratorio? Contatta KINTEK oggi per discutere le tue specifiche esigenze di laboratorio e come le nostre soluzioni possono guidare il tuo successo.
Guida Visiva
Prodotti correlati
- Fornace a Atmosfera Controllata da 1200℃ Fornace a Atmosfera Inerte di Azoto
- Fornace a atmosfera controllata da 1400℃ con azoto e atmosfera inerte
- Fornace a Idrogeno Inertee Controllato all'Azoto
- Fornace a atmosfera controllata da 1700℃ Fornace a atmosfera inerte di azoto
- Fornace a Tubo Rotante Divisa Multi Zona di Riscaldamento Fornace a Tubo Rotante
Domande frequenti
- Perché i gas inerti sono cruciali nella brasatura? Proteggi le giunzioni e migliora la qualità con azoto, elio e argon
- Cos'è un forno a atmosfera? Una guida al riscaldamento in ambiente controllato
- Quali sono i vantaggi dell'utilizzo di un gas inerte per prevenire l'ossidazione? Proteggere i materiali e migliorare la qualità
- Qual è lo scopo di mantenere un flusso continuo di argon? Ottimizzare il recupero di PLAP con alluminio ad alta purezza
- Come contribuisce un forno a muffola con atmosfera al processo di calcinazione? Trasformazione della Struttura Spinellare Master
- Perché vengono introdotti aria e vapore acqueo durante la pre-ossidazione? Padronanza della passivazione superficiale per esperimenti di cokizzazione
- Perché è necessario mantenere un'atmosfera inerte di azoto durante la pirolisi? Proteggi la sintesi del tuo nanocomposito
- Perché il forno usa l'azoto? Prevenire l'ossidazione per una lavorazione impeccabile ad alta temperatura



















