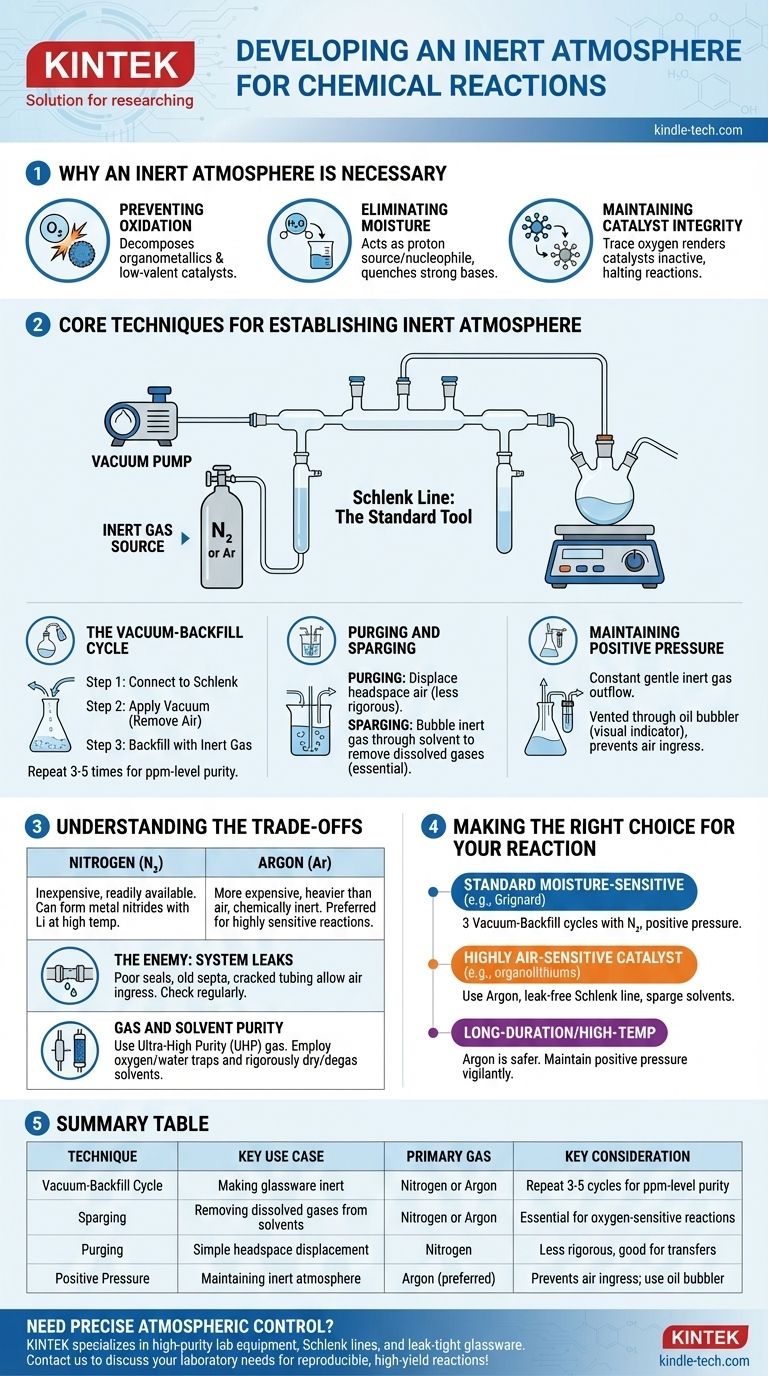
In pratica, un'atmosfera inerte viene creata rimuovendo fisicamente l'aria reattiva da un recipiente di reazione e sostituendola con un gas non reattivo, più comunemente azoto o argon. Ciò si ottiene tipicamente utilizzando un sistema a doppio collettore chiamato linea di Schlenk, che consente a un chimico di alternare l'applicazione di un vuoto al recipiente e il riempimento con il gas inerte. Questo ciclo viene ripetuto più volte per garantire la rimozione di tutto l'ossigeno e l'umidità.
L'obiettivo principale non è semplicemente aggiungere un gas inerte, ma spostare e rimuovere rigorosamente l'atmosfera reattiva già presente. Padroneggiare questo controllo sull'ambiente di reazione è fondamentale per prevenire reazioni collaterali indesiderate e garantire l'integrità dei materiali sensibili.

Perché è necessaria un'atmosfera inerte
Molte reazioni chimiche coinvolgono reagenti o producono prodotti sensibili ai componenti dell'aria ambiente. Non riuscire a controllare l'atmosfera può portare a reazioni fallite, basse rese o alla formazione di sottoprodotti pericolosi.
Prevenire l'ossidazione
Il colpevole più comune è l'ossigeno molecolare (O₂), un potente agente ossidante. Può reagire facilmente e decomporre molti reagenti comuni, in particolare organometallici, catalizzatori metallici a bassa valenza e intermedi radicalici.
Eliminare l'umidità
Il vapore acqueo (H₂O) è un'altra preoccupazione importante. Agisce come fonte di protoni (un acido debole) e un nucleofilo, che può spegnere basi forti (come i reagenti di Grignard o gli organolitio) o reagire con composti altamente elettrofili (come i cloruri acidi).
Mantenere l'integrità del catalizzatore
Nella catalisi, lo stato attivo di un catalizzatore metallico è spesso in uno specifico stato di ossidazione basso. L'esposizione anche a tracce di ossigeno può ossidare irreversibilmente il catalizzatore, rendendolo inattivo e bloccando la reazione.
Tecniche fondamentali per stabilire un'atmosfera inerte
Lo strumento standard per questo processo è una linea di Schlenk, un collettore di vetro collegato sia a una pompa a vuoto che a una fonte di gas inerte ad alta purezza. Questa configurazione consente due tecniche principali.
Il ciclo vuoto-riempimento
Questo è il metodo più comune per rendere inerte la vetreria.
- Il pallone di reazione vuoto e asciutto viene collegato alla linea di Schlenk.
- Viene applicato un vuoto, rimuovendo la maggior parte dell'aria dal pallone.
- Il vuoto viene chiuso e la valvola del gas inerte viene aperta, riempiendo il pallone con azoto o argon fino alla pressione ambiente.
Questo ciclo viene tipicamente ripetuto da tre a cinque volte per ridurre la concentrazione di ossigeno e umidità a livelli trascurabili (parti per milione).
Purging e Sparging
Il purging (spurgo) consiste semplicemente nel far passare un flusso costante di gas inerte attraverso lo spazio di testa del pallone per spostare l'aria. Questo è un metodo meno rigoroso ma può essere utile per semplici trasferimenti.
Lo sparging (gorgogliamento) è il processo di far gorgogliare il gas inerte attraverso un liquido (come un solvente di reazione) tramite un lungo ago o tubo. Questo è essenziale per rimuovere i gas disciolti, in particolare l'ossigeno, dal solvente prima che la reazione abbia inizio.
Mantenere una pressione positiva
Una volta stabilita l'atmosfera inerte, viene mantenuta una leggera pressione positiva del gas inerte durante l'esperimento. Ciò garantisce un costante e delicato flusso in uscita di gas, impedendo all'aria di fuoriuscire nel sistema. Questo flusso in uscita viene tipicamente sfogato attraverso un gorgogliatore a olio o mercurio, che serve anche come indicatore visivo della portata del gas.
Comprendere i compromessi
Scegliere il gas giusto ed essere consapevoli dei limiti del sistema sono fondamentali per il successo. Sebbene queste tecniche siano potenti, non sono infallibili.
Azoto vs. Argon
L'azoto (N₂) è il cavallo di battaglia per la maggior parte della chimica in atmosfera inerte. È economico e prontamente disponibile. Tuttavia, in determinate condizioni (ad esempio, reazioni con litio metallico ad alte temperature), può essere reattivo, formando nitruri metallici.
L'argon (Ar) è significativamente più costoso ma è più pesante dell'aria e chimicamente inerte in praticamente tutte le condizioni di laboratorio. È il gas preferito per reazioni altamente sensibili o quelle che coinvolgono metalli che possono reagire con N₂.
Il nemico: le perdite del sistema
L'efficacia della tua atmosfera inerte è buona solo quanto la guarnizione più debole della tua configurazione. Giunti di vetro mal ingrassati, vecchi setti di gomma o tubi incrinati possono consentire all'aria di rientrare lentamente nel sistema, compromettendo la reazione. Controllare regolarmente le perdite con un vacuometro è una pratica standard.
Purezza del gas e del solvente
Non basta semplicemente usare una bombola di gas inerte. Per lavori estremamente sensibili, è richiesto gas di altissima purezza (UHP). Inoltre, possono essere posizionate trappole per ossigeno o acqua in linea per "purificare" le ultime tracce di contaminanti dal gas prima che entri nel collettore. Allo stesso modo, i solventi devono essere rigorosamente essiccati e degassati (spesso tramite sparging) prima dell'uso.
Fare la scelta giusta per la tua reazione
Il tuo approccio specifico dovrebbe essere adattato alla sensibilità dei tuoi reagenti e all'obiettivo del tuo esperimento.
- Se il tuo obiettivo principale è una reazione standard sensibile all'umidità (ad es. Grignard): Eseguire tre cicli di vuoto-riempimento con azoto e mantenere una pressione positiva è tipicamente sufficiente.
- Se il tuo obiettivo principale è una reazione che utilizza un catalizzatore o un reagente altamente sensibile all'aria (ad es. organolitio, nichel a bassa valenza): L'uso di argon, la garanzia di una linea di Schlenk senza perdite e lo sparging dei solventi sono fondamentali per il successo.
- Se il tuo obiettivo principale è una reazione di lunga durata o ad alta temperatura: L'argon è la scelta più sicura per evitare potenziali reazioni collaterali con l'azoto, e devi rimanere vigile nel mantenere una pressione positiva per l'intera durata della reazione.
Padroneggiare queste tecniche di controllo atmosferico è ciò che ti dà un vero controllo sull'ambiente chimico, trasformando una reazione da una questione di fortuna in un processo prevedibile e riproducibile.
Tabella riassuntiva:
| Tecnica | Caso d'uso chiave | Gas primario | Considerazione chiave |
|---|---|---|---|
| Ciclo vuoto-riempimento | Rendere inerte la vetreria | Azoto o Argon | Ripetere 3-5 cicli per purezza a livello di ppm |
| Sparging | Rimozione di gas disciolti dai solventi | Azoto o Argon | Essenziale per reazioni sensibili all'ossigeno |
| Purging | Semplice spostamento dello spazio di testa | Azoto | Meno rigoroso, buono per i trasferimenti |
| Pressione positiva | Mantenere l'atmosfera inerte | Argon (preferito) | Previene l'ingresso di aria; usare gorgogliatore a olio |
Hai bisogno di un controllo atmosferico preciso per le tue reazioni sensibili? KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio ad alta purezza, incluse linee di Schlenk, sistemi di purificazione del gas e vetreria a tenuta stagna. I nostri esperti possono aiutarti a selezionare la configurazione giusta per prevenire l'ossidazione, eliminare l'umidità e mantenere l'integrità del catalizzatore. Contattaci oggi per discutere le tue specifiche esigenze di laboratorio e ottenere reazioni riproducibili e ad alta resa!
Guida Visiva
Prodotti correlati
- Fornace a Atmosfera Controllata da 1200℃ Fornace a Atmosfera Inerte di Azoto
- Fornace a atmosfera controllata da 1700℃ Fornace a atmosfera inerte di azoto
- Fornace a atmosfera controllata da 1400℃ con azoto e atmosfera inerte
- Fornace a Idrogeno Inertee Controllato all'Azoto
- Fornace a tubo da laboratorio ad alta temperatura da 1400℃ con tubo in allumina
Domande frequenti
- Quali gas vengono utilizzati nelle atmosfere inerti? Scegli il gas giusto per ambienti non reattivi
- Perché l'azoto viene utilizzato nei forni di ricottura? Per prevenire l'ossidazione e la decarburazione per una qualità superiore del metallo
- L'azoto può essere utilizzato per la brasatura? Condizioni chiave e applicazioni spiegate
- Come si crea un'atmosfera inerte? Padroneggia processi sicuri e puri con l'inertizzazione
- Qual è un esempio di atmosfera inerte? Scopri il miglior gas per il tuo processo



















