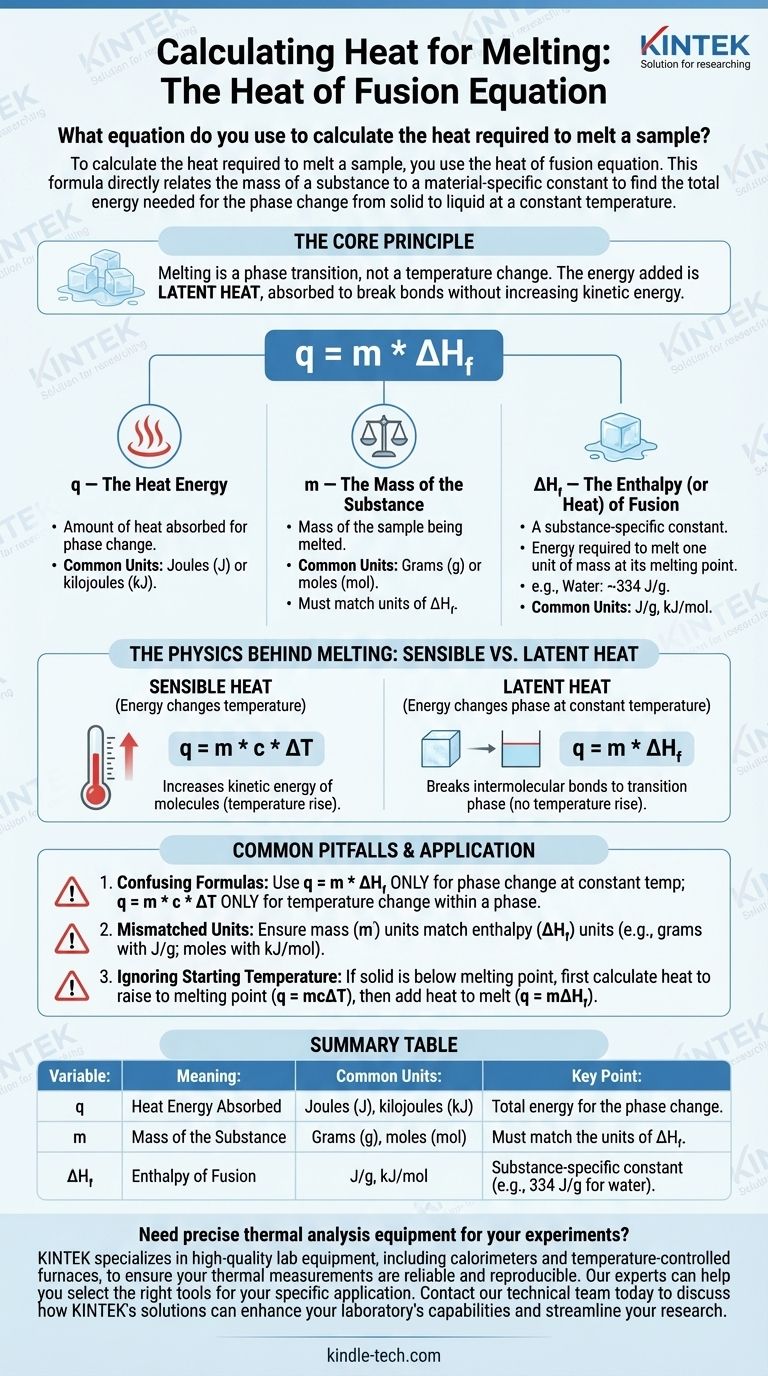
Per calcolare il calore necessario per fondere un campione, si usa l'equazione del calore di fusione. Questa formula mette in relazione diretta la massa di una sostanza con una costante specifica del materiale per trovare l'energia totale necessaria per il cambiamento di fase da solido a liquido a temperatura costante.
Il principio fondamentale è che la fusione è una transizione di fase, non un cambiamento di temperatura. L'energia che si aggiunge è chiamata calore latente, che viene assorbito per rompere i legami della struttura solida senza aumentare l'energia cinetica delle molecole.

Decomposizione dell'Equazione del Calore di Fusione
La formula per calcolare il calore assorbito durante la fusione è:
q = m * ΔH_f
Ogni variabile in questa equazione rappresenta un pezzo critico del processo fisico. Comprenderle individualmente è fondamentale per applicare correttamente la formula.
q — L'Energia Termica
q rappresenta la quantità di calore assorbita dalla sostanza per subire il cambiamento di fase. Questo valore è tipicamente espresso in Joule (J) o kilojoule (kJ), sebbene contesti più vecchi possano usare calorie (cal).
m — La Massa della Sostanza
m è la massa del campione che si sta fondendo. È cruciale che le unità di massa, tipicamente grammi (g) o moli (mol), corrispondano alle unità utilizzate nella costante del calore di fusione per quella sostanza.
ΔH_f — L'Entalpia (o Calore) di Fusione
ΔH_f è la variabile più importante. È l'entalpia di fusione, spesso chiamata calore latente di fusione.
Questa è una costante fisica unica per ogni sostanza. Definisce la quantità di energia necessaria per fondere un'unità di massa (ad esempio, 1 grammo o 1 mole) di quella sostanza al suo punto di fusione.
Ad esempio, il calore di fusione per l'acqua è di circa 334 Joule per grammo (J/g). Ciò significa che è necessario aggiungere 334 Joule di energia per fondere 1 grammo di ghiaccio a 0°C in 1 grammo di acqua liquida a 0°C.
La Fisica Dietro la Fusione: Calore Sensibile vs. Calore Latente
Un punto comune di confusione è perché la temperatura non aumenta durante la fusione. Questo è spiegato dalla differenza tra due tipi di energia termica.
Calore Sensibile
Il calore sensibile è l'energia che cambia la temperatura di una sostanza. Quando si aggiunge calore sensibile, si aumenta l'energia cinetica delle molecole, facendole muovere più velocemente, cosa che misuriamo come un aumento di temperatura. La formula per questo è q = m * c * ΔT.
Calore Latente
Il calore latente è l'energia assorbita o rilasciata durante un cambiamento di fase a temperatura costante. Durante la fusione, l'energia in ingresso viene utilizzata interamente per rompere i legami intermolecolari che tengono insieme il reticolo cristallino del solido, facendolo passare allo stato liquido.
Poiché l'energia è "nascosta" nel cambiamento di fase piuttosto che causare un aumento di temperatura, è chiamata latente.
Errori Comuni da Evitare
L'applicazione di un concetto o di una formula sbagliata è una frequente fonte di errore nei calcoli termodinamici. Sii consapevole di questi errori comuni.
Confondere il Calore di Fusione con il Calore Specifico
L'errore più comune è usare la formula sbagliata.
- Usa
q = m * ΔH_f(Calore di Fusione) SOLO per un cambiamento di fase a temperatura costante (es. fusione del ghiaccio a 0°C). - Usa
q = m * c * ΔT(Calore Specifico) SOLO per cambiare la temperatura di una sostanza all'interno di una singola fase (es. riscaldamento del ghiaccio solido da -10°C a 0°C).
Unità Non Corrispondenti
Controlla sempre le tue unità. Se la tua massa (m) è in grammi, il tuo calore di fusione (ΔH_f) deve essere in Joule per grammo (J/g). Se ΔH_f è dato in kilojoule per mole (kJ/mol), devi prima convertire la massa del tuo campione in moli.
Ignorare la Temperatura Iniziale
L'equazione del calore di fusione si applica solo se la sostanza è già al suo punto di fusione. Se hai un solido al di sotto del suo punto di fusione, devi eseguire un calcolo in due passaggi:
- Calcola il calore necessario per portare il solido al suo punto di fusione (
q = mcΔT). - Calcola il calore necessario per fondere il solido al suo punto di fusione (
q = mΔH_f). - Somma i risultati per il calore totale richiesto.
Applicare la Formula Corretta per il Tuo Calcolo
Per assicurarti di risolvere correttamente il tuo problema, identifica il processo esatto che devi calcolare.
- Se il tuo obiettivo principale è fondere una sostanza già al suo punto di fusione: Hai bisogno solo dell'equazione del calore di fusione:
q = m * ΔH_f. - Se il tuo obiettivo principale è riscaldare una sostanza senza cambiarne la fase: Hai bisogno solo dell'equazione della capacità termica specifica:
q = m * c * ΔT. - Se il tuo obiettivo principale è riscaldare un solido e poi fonderlo completamente: Devi calcolare il calore per entrambi i passaggi separatamente e sommarli:
q_totale = (m * c * ΔT)_riscaldamento + (m * ΔH_f)_fusione.
Comprendere quale processo fisico stai modellando è la chiave per selezionare l'equazione giusta.
Tabella Riepilogativa:
| Variabile | Significato | Unità Comuni | Punto Chiave |
|---|---|---|---|
| q | Energia Termica Assorbita | Joule (J), kilojoule (kJ) | Energia totale per il cambiamento di fase |
| m | Massa della Sostanza | Grammi (g), moli (mol) | Deve corrispondere alle unità di ΔH_f |
| ΔH_f | Entalpia di Fusione | J/g, kJ/mol | Costante specifica della sostanza (es. 334 J/g per l'acqua) |
Hai bisogno di attrezzature precise per l'analisi termica per i tuoi esperimenti?
Il calcolo accurato dei requisiti di calore è fondamentale nella scienza dei materiali, nella chimica e nella farmaceutica. KINTEK è specializzata in attrezzature da laboratorio di alta qualità, inclusi calorimetri e forni a temperatura controllata, per garantire che le tue misurazioni termiche siano affidabili e riproducibili.
I nostri esperti possono aiutarti a selezionare gli strumenti giusti per la tua applicazione specifica, sia che tu stia studiando cambiamenti di fase, sintesi di materiali o cinetica di reazione.
Contatta oggi il nostro team tecnico per discutere come le soluzioni KINTEK possono migliorare le capacità del tuo laboratorio e ottimizzare la tua ricerca.
Guida Visiva
Prodotti correlati
- Pressa idraulica riscaldata con piastre riscaldate manuali integrate per uso in laboratorio
- Macchina per pressa idraulica riscaldata 24T 30T 60T con piastre riscaldate per pressa a caldo da laboratorio
- Pressa Elettrica Riscaldante Cilindrica per Applicazioni di Laboratorio
- Pressa Idraulica Riscaldata Automatica con Piastre Riscaldate per Pressa a Caldo da Laboratorio 25T 30T 50T
- Pressa per stampi a infrarossi da laboratorio
Domande frequenti
- A cosa serve una pressa idraulica riscaldata? Strumento essenziale per la polimerizzazione, lo stampaggio e la laminazione
- Una pressa idraulica ha calore? Come gli stampi riscaldati sbloccano lo stampaggio e la vulcanizzazione avanzati
- Come funziona una pressa a caldo idraulica? Sblocca la precisione nell'incollaggio e nella formatura dei materiali
- Cos'è una pressa a caldo idraulica? Una guida alla precisione di calore e pressione per la produzione
- Cos'è una pressa idraulica a caldo? Sblocca la potenza del calore e della pressione per i materiali avanzati


























