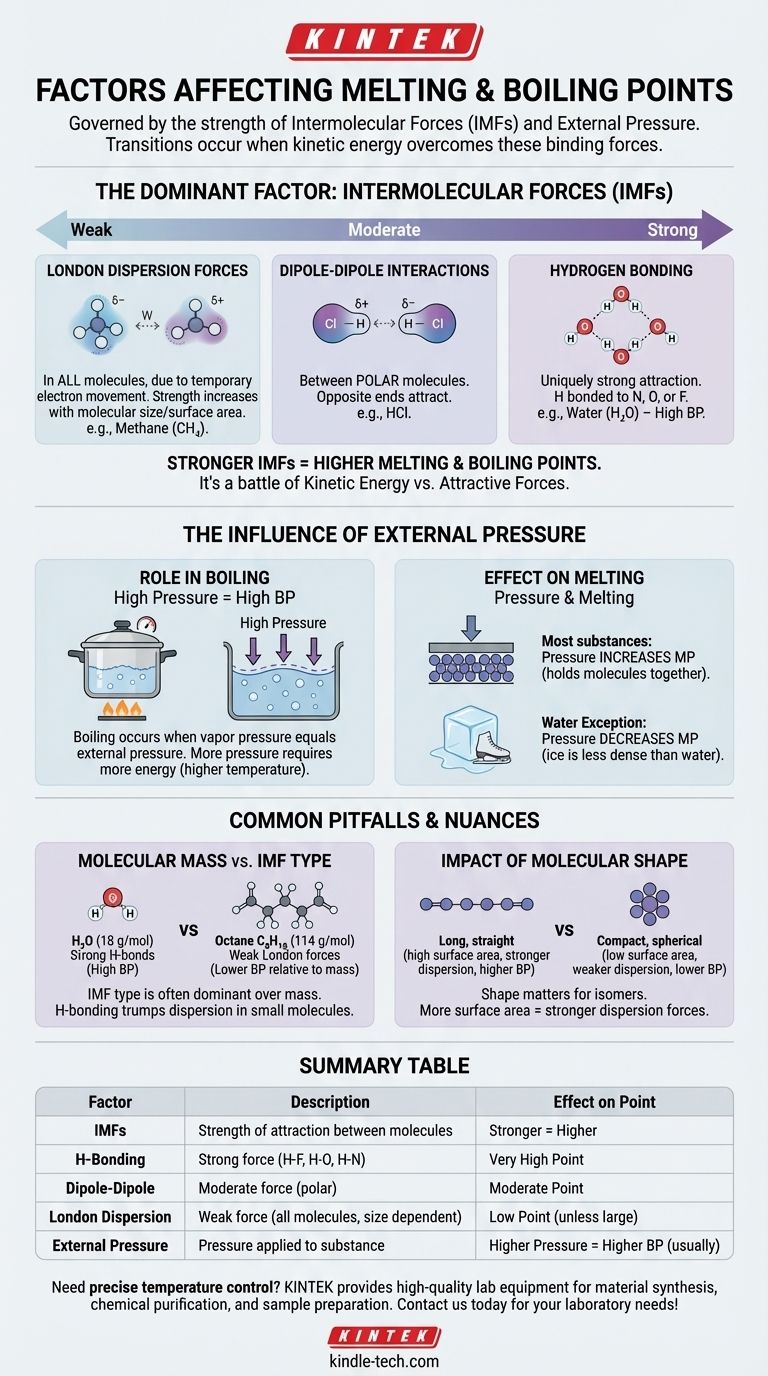
A livello fondamentale, i punti di fusione ed ebollizione di una sostanza sono governati da due fattori principali: la forza delle forze intermolecolari (IMF) che tengono unite le sue molecole e la pressione esterna applicata ad essa. Essenzialmente, queste transizioni avvengono quando le molecole acquisiscono energia sufficiente per superare le forze che le legano e la pressione che le contiene.
Il concetto fondamentale è che la fusione e l'ebollizione non riguardano solo la temperatura; sono una battaglia fisica tra l'energia cinetica di una molecola e le forze attrattive che la legano ai suoi vicini. Più forti sono queste attrazioni, più energia è necessaria per separarle.

Il Fattore Dominante: Le Forze Intermolecolari (IMF)
Il fattore più importante nel determinare i punti di fusione ed ebollizione di una sostanza è la forza delle attrazioni tra le sue singole molecole. Questi non sono i forti legami covalenti all'interno di una molecola, ma le forze più deboli che fanno sì che le molecole aderiscano l'una all'altra.
Cosa Sono le Forze Intermolecolari?
Pensa alle IMF come all'equivalente molecolare dei magneti. Alcune molecole sono come potenti elettromagneti, mentre altre sono come deboli magneti da frigorifero. Superare questa "appiccicosità" richiede energia sotto forma di calore.
La Gerarchia delle Forze
Le forze intermolecolari variano in forza, creando una gerarchia chiara. Comprendere questa gerarchia è fondamentale per prevedere quali sostanze avranno punti di ebollizione più alti o più bassi.
Legame a Idrogeno (Il più forte) Questo è un tipo di attrazione eccezionalmente forte che si verifica quando l'idrogeno è legato a un atomo altamente elettronegativo come azoto (N), ossigeno (O) o fluoro (F). L'acqua (H₂O) è l'esempio classico, e i suoi potenti legami a idrogeno sono il motivo per cui ha un punto di ebollizione così notevolmente alto per le sue piccole dimensioni.
Interazioni Dipolo-Dipolo (Moderate) Queste forze esistono tra molecole polari—molecole che hanno una carica parziale positiva permanente su un'estremità e una carica parziale negativa sull'altra. Queste estremità opposte si attraggono, tenendo la sostanza moderatamente unita.
Forze di Dispersione di London (Le più deboli) Queste forze esistono in tutte le molecole, causate dal movimento temporaneo e casuale degli elettroni che crea dipoli fugaci. Sebbene deboli individualmente, diventano più significative all'aumentare delle dimensioni e dell'area superficiale della molecola. Questo è il motivo per cui molecole più grandi come l'ottano (C₈H₁₈) sono liquidi a temperatura ambiente, mentre quelle più piccole come il metano (CH₄) sono gas.
L'Influenza della Pressione Esterna
La pressione esterna agisce come un coperchio fisico su una sostanza, rendendo più difficile per le molecole sfuggire alla fase successiva (da solido a liquido o da liquido a gas).
Il Ruolo della Pressione nell'Ebollizione
L'ebollizione si verifica quando la pressione di vapore interna di un liquido eguaglia la pressione atmosferica esterna.
Se si aumenta la pressione esterna (ad esempio, utilizzando una pentola a pressione), si aumenta il punto di ebollizione perché le molecole necessitano di più energia per spingere contro quella forza esterna più forte.
Al contrario, se si diminuisce la pressione esterna (ad esempio, andando ad alta quota), si abbassa il punto di ebollizione. Ecco perché l'acqua bolle a una temperatura più bassa a Denver rispetto a quanto non faccia a livello del mare.
L'Effetto della Pressione sulla Fusione
Per la maggior parte delle sostanze, l'aumento della pressione aumenta leggermente il punto di fusione. Questo perché la pressione aiuta a mantenere le molecole nella struttura rigida e strettamente impacchettata di un solido.
L'acqua è una famosa eccezione. Poiché il ghiaccio solido è meno denso dell'acqua liquida, l'applicazione di pressione in realtà facilita la fusione. Questo è il motivo per cui la lama di un pattinatore può scivolare sul ghiaccio.
Errori Comuni e Sfumature
Guardare semplicemente un fattore può essere fuorviante. L'interazione tra forze, massa e forma crea importanti sfumature.
Massa Molecolare rispetto alla Forza Intermolecolare
Sebbene i punti di ebollizione generalmente aumentino con la massa molare, il tipo di IMF è molto più dominante.
Una molecola piccola con forti legami a idrogeno, come l'acqua (18 g/mol, bolle a 100°C), avrà un punto di ebollizione notevolmente più alto rispetto a una molecola di dimensioni simili con solo deboli forze di dispersione, come il metano (16 g/mol, bolle a -161,5°C).
L'Impatto della Forma Molecolare
Per le molecole con la stessa formula chimica (isomeri), la forma conta. Le molecole lunghe e dritte hanno più superficie di contatto, portando a forze di dispersione di London più forti e punti di ebollizione più alti.
Le molecole compatte e sferiche hanno meno superficie e quindi attrazioni più deboli e punti di ebollizione più bassi.
Fare la Previsione Corretta
Combinando questi principi, è possibile valutare accuratamente perché sostanze diverse si comportano come fanno.
- Se il tuo obiettivo principale è confrontare sostanze diverse: Per prima cosa, identifica la forza intermolecolare più forte presente in ciascuna; questo sarà quasi sempre il determinante principale dei loro punti di ebollizione relativi.
- Se il tuo obiettivo principale è cambiare le condizioni di una sostanza: Analizza come le variazioni di pressione esterna influenzeranno l'energia richiesta per una transizione di fase, specialmente per l'ebollizione.
- Se incontri un risultato inaspettato: Considera fattori secondari come la forma molecolare o le proprietà di densità uniche della sostanza, come si vede con l'acqua.
Comprendendo questi principi fondamentali, puoi passare dal semplice memorizzare punti di fusione ed ebollizione al comprendere veramente il comportamento fisico della materia.
Tabella Riassuntiva:
| Fattore | Descrizione | Effetto sul Punto di Fusione/Ebollizione |
|---|---|---|
| Forze Intermolecolari (IMF) | Forza di attrazione tra le molecole. | Forze più forti = Punto più alto |
| Legame a Idrogeno | Forza forte con legami H-F, H-O, H-N. | Punto molto alto |
| Dipolo-Dipolo | Forza moderata tra molecole polari. | Punto moderato |
| Dispersione di London | Forza debole in tutte le molecole, aumenta con la dimensione. | Punto basso (a meno che la molecola non sia grande) |
| Pressione Esterna | Pressione applicata alla sostanza. | Pressione più alta = Punto di ebollizione più alto (di solito) |
Hai bisogno di un controllo preciso della temperatura per i tuoi processi di laboratorio? Comprendere le transizioni di fase è fondamentale per applicazioni come la sintesi di materiali, la purificazione chimica e la preparazione di campioni. Noi di KINTEK siamo specializzati in attrezzature da laboratorio di alta qualità, inclusi forni, stufe e sistemi di controllo della temperatura, progettati per fornire l'accuratezza e l'affidabilità che la tua ricerca richiede. Lascia che i nostri esperti ti aiutino a selezionare l'attrezzatura perfetta per la tua specifica applicazione. Contattaci oggi per discutere le tue esigenze di laboratorio!
Guida Visiva
Prodotti correlati
- Fornace per Trattamento Termico Sottovuoto e Fornace per Fusione a Induzione a Levitazione
- Sistema di filatura per fusione a induzione sotto vuoto Forno ad arco
- Fornace a Induzione Sottovuoto su Scala di Laboratorio
- Pressa Idraulica Riscaldata Automatica con Piastre Riscaldate per Pressa a Caldo da Laboratorio 25T 30T 50T
- Pressa idraulica riscaldata con piastre riscaldate manuali integrate per uso in laboratorio
Domande frequenti
- Quali sono i tre principali trattamenti termici? Padroneggiare la Ricottura, la Tempra e il Rinvenimento
- Quali sono i cinque processi fondamentali di trattamento termico dei metalli? Ricottura, Tempra e altro ancora
- Quali sono le parti di un forno a vuoto? Una guida ai 5 sistemi principali
- Cos'è un forno per trattamento termico sottovuoto? La guida definitiva alla lavorazione in atmosfera controllata
- Perché si esegue il trattamento termico sotto vuoto? Ottenere una finitura superficiale e un'integrità del materiale perfette






















