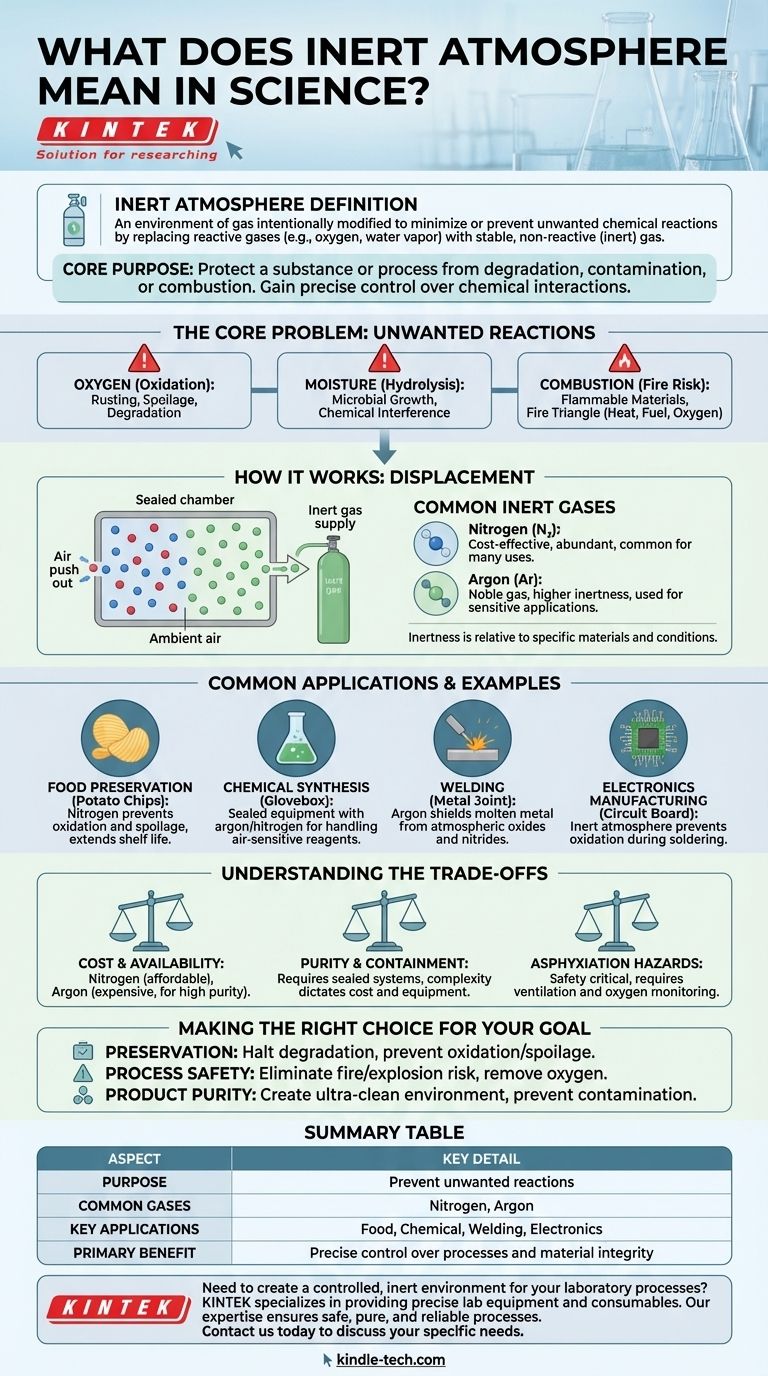
In un contesto scientifico, un'atmosfera inerte si riferisce a un ambiente gassoso che è stato intenzionalmente modificato per minimizzare o prevenire reazioni chimiche indesiderate. Ciò si ottiene sostituendo gas reattivi, più comunemente ossigeno e vapore acqueo, con un gas stabile e non reattivo (o "inerte") come azoto o argon.
Lo scopo principale della creazione di un'atmosfera inerte è proteggere una sostanza o un processo dal degrado, dalla contaminazione o dalla combustione. Rimuovendo gli elementi reattivi dall'ambiente, si ottiene un controllo preciso sulle interazioni chimiche che possono verificarsi.

Il problema fondamentale: reazioni indesiderate
Per capire perché le atmosfere inerti sono necessarie, dobbiamo prima identificare i problemi che risolvono. L'aria ambiente è una miscela di gas sorprendentemente reattiva e spesso ostile a materiali e processi sensibili.
Il ruolo dell'ossigeno
L'ossigeno è il colpevole più comune. È altamente reattivo e partecipa prontamente all'ossidazione, un processo che può alterare fondamentalmente i materiali.
Ciò include la ruggine dei metalli, il deterioramento degli alimenti e la degradazione di composti chimici sensibili.
L'impatto dell'umidità
Il vapore acqueo presente nell'aria è un'altra fonte importante di reazioni indesiderate. Può idrolizzare materiali sensibili, promuovere la crescita microbica o interferire con la sintesi chimica.
Il rischio di combustione
Molti processi coinvolgono materiali infiammabili o alte temperature. La presenza di ossigeno crea un rischio significativo di incendio o esplosione, poiché è un componente chiave del triangolo del fuoco (calore, combustibile e ossigeno).
Come funziona un'atmosfera inerte
La soluzione è concettualmente semplice: sostituire l'atmosfera reattiva con una non reattiva. Ciò si ottiene tipicamente attraverso un processo di spurgo o spostamento.
Il principio di spostamento
Il processo prevede il lavaggio di un contenitore o di una camera sigillata (come una glovebox o un recipiente di reazione) con un gas inerte. Questo nuovo gas spinge fisicamente fuori l'aria ambiente, sostituendo efficacemente l'ossigeno e l'umidità reattivi con un gas stabile.
Gas inerti comuni
La scelta del gas dipende dall'applicazione specifica, dal costo e dal livello di inerzia richiesto.
Il più comune è l'Azoto (N₂), che è efficace per molte applicazioni e relativamente economico. Per situazioni che richiedono una purezza maggiore o sono più esigenti, si utilizzano gas nobili come l'Argon (Ar) perché sono ancora meno reattivi.
Il concetto di "inerzia"
È importante capire che "inerte" è un termine relativo. Un gas è considerato inerte se non reagisce con gli specifici materiali in un dato sistema in determinate condizioni. L'azoto, ad esempio, è inerte per la maggior parte degli scopi ma può reagire a temperature e pressioni molto elevate.
Applicazioni ed esempi comuni
L'uso pratico delle atmosfere inerti è diffuso nella scienza e nell'industria, spesso in modi che incontri quotidianamente.
Nella conservazione degli alimenti
L'aria all'interno di una busta di patatine non è semplicemente "aria", è tipicamente azoto. Questa atmosfera inerte impedisce agli oli nelle patatine di ossidarsi e irrancidire, estendendone notevolmente la durata di conservazione.
Nella sintesi chimica
Molti reagenti chimici sono estremamente sensibili all'aria o all'umidità. I chimici utilizzano apparecchiature sigillate spurgate con argon o azoto per manipolare questi materiali, assicurando che le loro reazioni procedano come previsto senza contaminazione.
Nella saldatura e metallurgia
Quando si saldano leghe ad alta resistenza, si utilizza un gas inerte come l'argon per proteggere il metallo fuso dall'atmosfera. Ciò impedisce la formazione di ossidi e nitruri che altrimenti indebolirebbero la saldatura.
Nella produzione di elettronica
Durante la saldatura di microchip e circuiti stampati, i componenti sono vulnerabili all'ossidazione. Un'atmosfera inerte lo impedisce, assicurando la formazione di connessioni elettriche forti e affidabili.
Comprendere i compromessi
Sebbene potenti, l'implementazione di un'atmosfera inerte comporta considerazioni pratiche che devono essere ponderate.
Costo e disponibilità
L'azoto è abbondante ed economico, il che lo rende il cavallo di battaglia per molte applicazioni industriali. L'argon ad alta purezza e altri gas nobili sono significativamente più costosi e sono riservati a quando la non reattività assoluta è fondamentale.
Purezza e contenimento
Mantenere un'atmosfera veramente inerte richiede sistemi ben sigillati. Il livello di purezza richiesto determina la complessità e il costo delle apparecchiature, dai semplici contenitori spurgati a glovebox sofisticate con circolazione e purificazione costante del gas.
Pericoli di asfissia
Una considerazione critica per la sicurezza è che i gas inerti spostano l'ossigeno. In un'area scarsamente ventilata, una perdita può creare un ambiente carente di ossigeno che può causare asfissia. Una ventilazione adeguata e il monitoraggio dell'ossigeno sono misure di sicurezza essenziali.
Fare la scelta giusta per il tuo obiettivo
La decisione di utilizzare un'atmosfera inerte è guidata dal risultato specifico che è necessario ottenere.
- Se la tua attenzione principale è la conservazione: Il tuo obiettivo è arrestare il degrado spostando ossigeno e umidità, prevenendo così l'ossidazione e il deterioramento.
- Se la tua attenzione principale è la sicurezza del processo: Il tuo obiettivo è eliminare il rischio di incendio o esplosione rimuovendo l'ossigeno necessario per la combustione.
- Se la tua attenzione principale è la purezza del prodotto: Il tuo obiettivo è creare un ambiente ultra-pulito, assicurando che nessun contaminante reattivo possa interferire con un processo sensibile come la sintesi chimica o la produzione di elettronica.
In definitiva, un'atmosfera inerte è un potente strumento per prendere il controllo di un ambiente chimico per ottenere un risultato preciso e affidabile.
Tabella riassuntiva:
| Aspetto | Dettaglio chiave |
|---|---|
| Scopo | Prevenire reazioni indesiderate (ossidazione, contaminazione, combustione) |
| Gas comuni | Azoto (N₂), Argon (Ar) |
| Applicazioni chiave | Conservazione degli alimenti, sintesi chimica, saldatura, produzione di elettronica |
| Beneficio principale | Controllo preciso dei processi chimici e integrità dei materiali |
Hai bisogno di creare un ambiente inerte controllato per i tuoi processi di laboratorio? KINTEK è specializzata nel fornire le attrezzature e i materiali di consumo di laboratorio precisi necessari per le tue applicazioni, dalla sintesi chimica alla ricerca sui materiali. La nostra esperienza assicura che i tuoi processi siano sicuri, puri e affidabili. Contattaci oggi stesso per discutere le tue esigenze specifiche e scoprire la soluzione giusta per il tuo laboratorio.
Guida Visiva
Prodotti correlati
- Fornace a atmosfera controllata da 1400℃ con azoto e atmosfera inerte
- Fornace a Atmosfera Controllata da 1200℃ Fornace a Atmosfera Inerte di Azoto
- Fornace a atmosfera controllata da 1700℃ Fornace a atmosfera inerte di azoto
- Fornace a Idrogeno Inertee Controllato all'Azoto
- Fornace a tubo da laboratorio ad alta temperatura da 1400℃ con tubo in allumina
Domande frequenti
- Perché l'azoto viene utilizzato nei forni di ricottura? Per prevenire l'ossidazione e la decarburazione per una qualità superiore del metallo
- L'azoto può essere utilizzato per la brasatura? Condizioni chiave e applicazioni spiegate
- Qual è lo scopo dell'atmosfera inerte? Una guida per proteggere i tuoi materiali e processi
- Cos'è l'atmosfera di azoto per la ricottura? Ottenere un trattamento termico senza ossidazione
- Cos'è un trattamento termico in atmosfera inerte? Proteggi i tuoi metalli da ossidazione e decarburazione



















