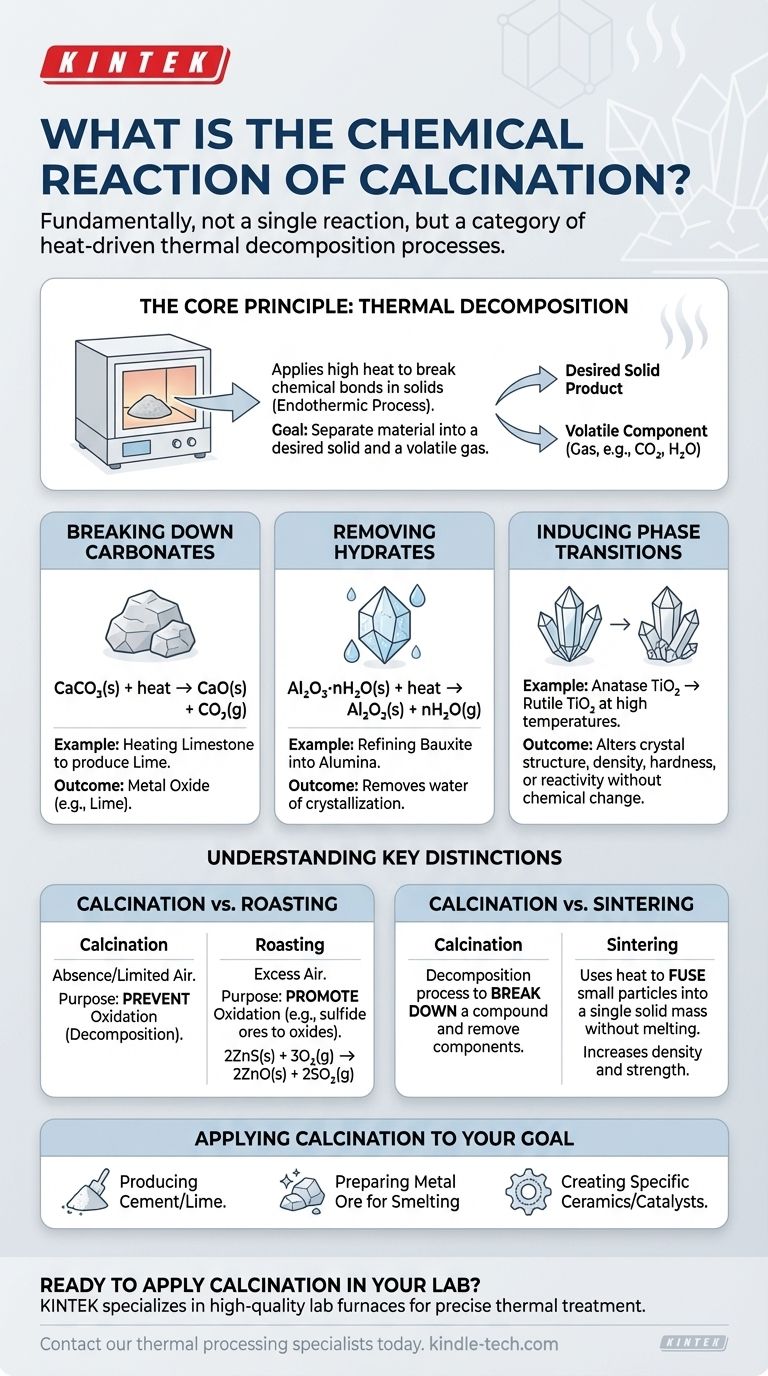
Fondamentalmente, la calcinazione non è una singola reazione chimica, ma piuttosto una categoria di processi guidati dal calore definiti da un risultato specifico: la decomposizione termica. Sebbene molte reazioni rientrino in questo ambito, l'esempio più comune è la scomposizione di un carbonato, come il riscaldamento del calcare (carbonato di calcio) per produrre calce (ossido di calcio) e anidride carbonica gassosa.
La calcinazione è un processo di trattamento termico che utilizza calore elevato in un'atmosfera controllata per scomporre un materiale. Il suo scopo principale è eliminare un componente volatile, come l'anidride carbonica o l'acqua, per purificare o alterare le proprietà chimiche e fisiche del solido rimanente.

Il Principio Fondamentale: Decomposizione Termica
La calcinazione funziona applicando sufficiente energia termica a un solido per rompere i suoi legami chimici. Questo processo è sempre endotermico, il che significa che richiede un apporto di energia (calore) per procedere. L'obiettivo è separare il materiale in un prodotto solido desiderato e un componente volatile che può essere eliminato come gas.
Scomposizione dei Carbonati
Questa è l'applicazione classica e più diffusa della calcinazione, in particolare nella produzione di cemento. Quando un carbonato metallico viene riscaldato, si decompone in un ossido metallico e anidride carbonica gassosa.
Per il calcare, la reazione è:
CaCO₃(s) + calore → CaO(s) + CO₂(g)
Qui, il carbonato di calcio solido si scompone in ossido di calcio solido (calce) e anidride carbonica gassosa.
Rimozione degli Idrocarburi (Acqua di Cristallizzazione)
Molti minerali esistono come idrati, il che significa che le molecole d'acqua sono incorporate nella loro struttura cristallina. La calcinazione viene utilizzata per eliminare quest'acqua, un processo spesso chiamato "essiccazione", sebbene sia una decomposizione chimica.
Ad esempio, la raffinazione del minerale di bauxite in allumina comporta la calcinazione dell'ossido di alluminio idrato:
Al₂O₃·nH₂O(s) + calore → Al₂O₃(s) + nH₂O(g)
Questo passaggio rimuove l'acqua, concentrando l'ossido di alluminio, che è un precursore necessario per la produzione di alluminio metallico.
Induzione di Transizioni di Fase
Meno comunemente, la calcinazione può riferirsi a un processo in cui il calore non provoca la decomposizione, ma cambia invece la struttura cristallina (fase) di un materiale. Ciò altera le sue proprietà fisiche, come densità, durezza o reattività, senza modificarne la formula chimica.
Un esempio è la conversione dell'anatase, una forma di biossido di titanio (TiO₂), nella sua fase rutilo più stabile ad alte temperature.
Comprendere le Distinzioni Chiave
Il valore della calcinazione diventa più chiaro se confrontato con altri processi termici comuni. Le condizioni specifiche, in particolare l'atmosfera, definiscono il risultato.
Calcinazione vs. Tostatura
Questa è la distinzione più critica. La calcinazione avviene in assenza o in fornitura limitata di aria per prevenire intenzionalmente l'ossidazione.
La tostatura, al contrario, viene eseguita in eccesso d'aria specificamente per promuovere l'ossidazione. Viene tipicamente utilizzata per i minerali solfuri, convertendoli in ossidi. Ad esempio, la tostatura del solfuro di zinco:
2ZnS(s) + 3O₂(g) → 2ZnO(s) + 2SO₂(g)
Calcinazione vs. Sinterizzazione
Questi processi hanno obiettivi opposti. La calcinazione è un processo di decomposizione utilizzato per scomporre un composto e rimuovere un componente.
La sinterizzazione, invece, utilizza il calore (al di sotto del punto di fusione) per fondere piccole particelle in un'unica massa solida. Aumenta la densità e la resistenza, essenzialmente "saldando" il materiale insieme senza fonderlo.
Applicare la Calcinazione al Vostro Obiettivo
La specifica reazione di calcinazione che vi interessa dipende interamente dal materiale di partenza e dal prodotto finale desiderato.
- Se il vostro obiettivo principale è la produzione di cemento o calce: State utilizzando la calcinazione per decomporre il carbonato di calcio in ossido di calcio reattivo.
- Se il vostro obiettivo principale è la preparazione di un minerale metallico per la fusione: State probabilmente utilizzando la calcinazione per rimuovere l'acqua (dagli idrati) o l'anidride carbonica (dai carbonati) per arricchire il contenuto metallico.
- Se il vostro obiettivo principale è creare una specifica ceramica o catalizzatore: Potreste utilizzare la calcinazione per ottenere una desiderata fase cristallina e area superficiale in un materiale come l'allumina o la titania.
In definitiva, la calcinazione è uno strumento fondamentale nella scienza dei materiali per trasformare solidi grezzi in forme più utili, concentrate o reattive.
Tabella Riassuntiva:
| Tipo di Reazione di Calcinazione | Reazione Esempio | Risultato Chiave |
|---|---|---|
| Decomposizione del Carbonato | CaCO₃(s) + calore → CaO(s) + CO₂(g) |
Produce ossido metallico (es. calce) |
| Decomposizione dell'Idrato | Al₂O₃·nH₂O(s) + calore → Al₂O₃(s) + nH₂O(g) |
Rimuove l'acqua di cristallizzazione |
| Transizione di Fase | TiO₂ Anatase → TiO₂ Rutilo | Altera la struttura cristallina e le proprietà |
Pronti ad applicare la calcinazione nel vostro laboratorio?
Che stiate sviluppando nuovi catalizzatori, lavorando minerali o sintetizzando ceramiche avanzate, un trattamento termico preciso è fondamentale. KINTEK è specializzata in forni da laboratorio e attrezzature di alta qualità progettate per processi di calcinazione affidabili.
Forniamo gli strumenti necessari per ottenere un riscaldamento uniforme, un controllo preciso della temperatura e risultati coerenti. Lasciate che i nostri esperti vi aiutino a selezionare l'attrezzatura giusta per il vostro materiale e applicazione specifici.
Contattate oggi i nostri specialisti in processi termici per discutere le esigenze del vostro progetto e scoprire come KINTEK può migliorare la vostra ricerca e sviluppo.
Guida Visiva
Prodotti correlati
- Impianto di pirolisi a forno rotante elettrico Macchina Calcinatore Piccolo Forno Rotante Forno Rotante
- Fornace a Pirolisi Continua Elettrica Rotante per Lavorazione Piccola Scala
- Fornace Rotante Elettrica per la Rigenerazione del Carbone Attivo
- Fornace a Tubo Rotante a Lavoro Continuo Sottovuoto Fornace a Tubo Rotante
- Fornace a Tubo al Quarzo per Trattamento Termico Rapido (RTP) da Laboratorio
Domande frequenti
- Quali sono le applicazioni industriali della pirolisi? Trasformare i rifiuti in energia e prodotti di valore
- Quali sono i prodotti della pirolisi del legno? Una guida alle rese di biochar, bio-olio e syngas
- Quali sono i diversi tipi di reattori nella pirolisi della plastica? Scegli il sistema giusto per i tuoi rifiuti
- Quale attrezzatura viene utilizzata nella pirolisi? Scegliere il reattore giusto per la vostra materia prima e i vostri prodotti
- Qual è il principio del forno rotante? Padroneggiare la lavorazione termica continua



















