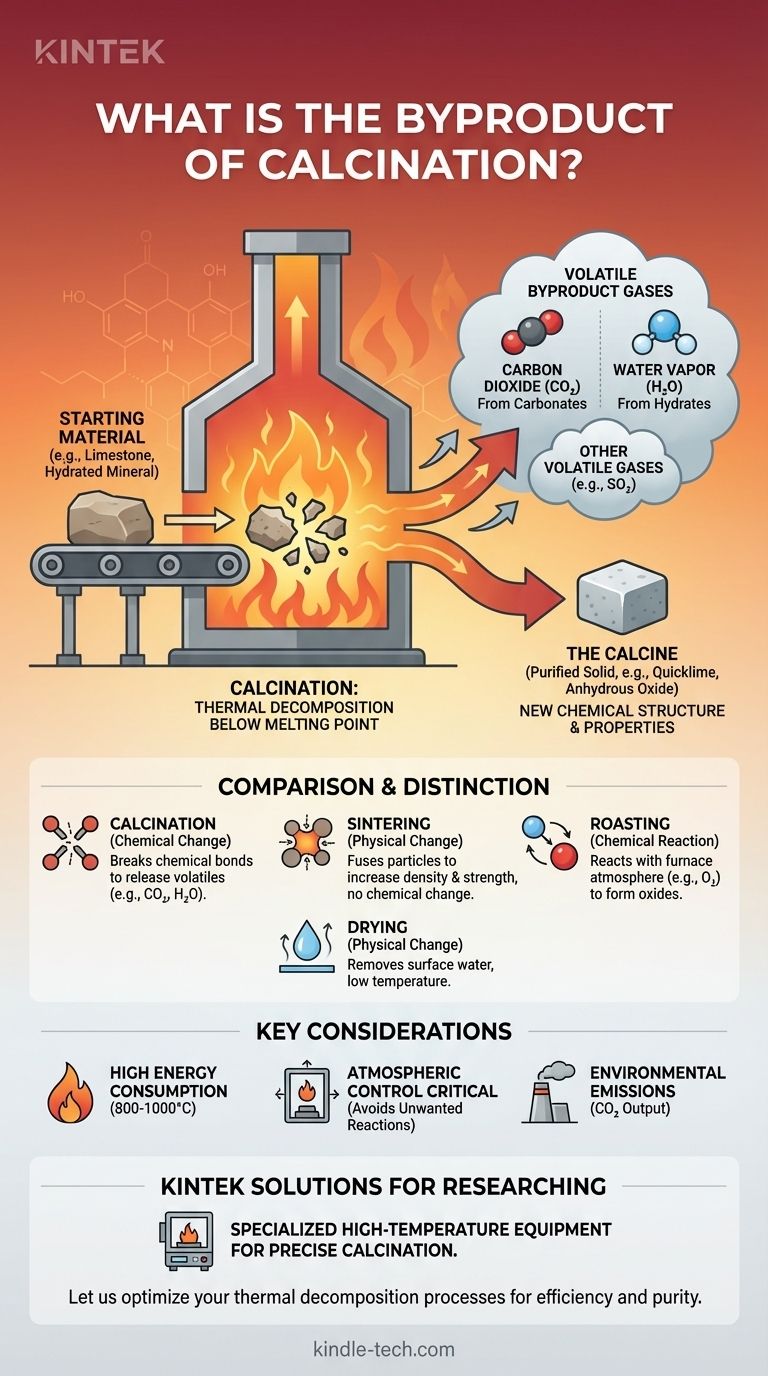
Nella quasi totalità dei casi, il sottoprodotto primario della calcinazione è un gas. Questo è più comunemente anidride carbonica (CO2) quando si riscaldano carbonati come il calcare, o vapore acqueo (H2O) quando si riscaldano minerali idrati. Il processo è una forma di decomposizione termica, in cui il calore intenso scompone un composto in un solido purificato e gas volatili che vengono allontanati.
La calcinazione è un processo di trasformazione chimica, non semplicemente di purificazione. Utilizza alte temperature al di sotto del punto di fusione per decomporre un materiale, modificando fondamentalmente la sua struttura chimica allontanando sottoprodotti volatili come anidride carbonica o vapore acqueo.

Cos'è la Calcinazione? Uno Sguardo Più Approfondito
La calcinazione è un processo fondamentale nella metallurgia e nella scienza dei materiali, in particolare nella produzione di cemento, calce e nella raffinazione di alcuni minerali. Comprendere il meccanismo è la chiave per capirne lo scopo.
Il Principio Fondamentale: Decomposizione Termica
Nel suo cuore, la calcinazione consiste nel rompere i legami chimici con il calore. L'energia applicata fa sì che il materiale di partenza si decomponga in due o più nuove sostanze.
Una di queste sostanze è il prodotto solido desiderato, spesso chiamato "calcinato". Le altre sostanze sono i sottoprodotti gassosi che vengono rimossi.
Sottoprodotti Comuni Spiegati
Il sottoprodotto specifico dipende interamente dalla composizione chimica del materiale riscaldato.
- Anidride Carbonica (CO2): Questo è l'esempio più famoso. Quando il carbonato di calcio (CaCO3, calcare) viene calcinato, si scompone in ossido di calcio (CaO, calce viva) e rilascia gas CO2. Questa è la reazione centrale nella produzione di cemento.
- Vapore Acqueo (H2O): Molti minerali esistono come idrati, il che significa che hanno molecole d'acqua bloccate nella loro struttura cristallina. La calcinazione della bauxite (minerale di alluminio) o del gesso rimuove quest'acqua chimicamente legata sotto forma di vapore.
- Altri Gas Volatili: In applicazioni più specifiche, possono essere rilasciati altri gas. Ad esempio, il riscaldamento di alcuni solfati può rilasciare anidride solforosa (SO2), sebbene questo processo spesso si sovrapponga a una tecnica correlata chiamata arrostimento.
Il Prodotto Desiderato: Il Calcinato
Il materiale solido rimasto dopo che i sottoprodotti volatili sono stati allontanati è l'obiettivo primario. Questo calcinato risultante ha ora proprietà chimiche e fisiche diverse.
Ad esempio, la calce viva prodotta dalla calcinazione del calcare è altamente reattiva, il che è essenziale per la produzione di cemento e altri prodotti chimici industriali.
Come la Calcinazione Differisce da Altri Trattamenti Termici
Il termine "calcinazione" è spesso confuso con altri processi ad alta temperatura. La distinzione risiede nell'obiettivo chimico o fisico sottostante.
Calcinazione vs. Sinterizzazione
La calcinazione modifica la composizione chimica di un materiale. Scompone un composto in un altro rimuovendo componenti volatili.
La sinterizzazione, come correttamente notato nel riferimento, modifica la forma fisica di un materiale. Utilizza il calore per fondere piccole particelle insieme in un unico pezzo solido senza fonderle, aumentandone la forza e la densità. La composizione chimica rimane invariata.
Calcinazione vs. Arrostimento
Questo è un punto di confusione molto comune. La calcinazione viene tipicamente eseguita in un'atmosfera controllata o inerte per causare la decomposizione.
L'arrostimento, al contrario, è un processo che coinvolge una reazione chimica con l'atmosfera del forno, in particolare con l'ossigeno. È una forma di ossidazione, spesso utilizzata per convertire i minerali di solfuro metallico in ossidi metallici.
Calcinazione vs. Essiccazione
L'essiccazione è un processo a bassa temperatura che rimuove l'acqua fisicamente assorbita dalla superficie di una sostanza.
La calcinazione è un processo ad alta temperatura che rimuove l'acqua chimicamente legata o altri composti volatili dalla struttura cristallina del materiale, richiedendo molta più energia per rompere quei legami chimici.
Comprendere le Insidie e il Contesto
Sebbene potente, la calcinazione è un processo industriale con significative considerazioni operative che devono essere gestite.
Elevato Consumo Energetico
Raggiungere e mantenere le alte temperature richieste per rompere i legami chimici (spesso 800-1000°C o superiori) rende la calcinazione un processo estremamente energivoro e costoso.
Il Controllo Atmosferico è Cruciale
La composizione del gas all'interno del forno è fondamentale. Reazioni indesiderate, come l'ossidazione da eccesso d'aria, possono verificarsi se l'atmosfera non è attentamente controllata, portando a un prodotto finale impuro.
Emissioni Ambientali
I sottoprodotti gassosi sono un output primario. La calcinazione del calcare per la produzione di cemento è una delle maggiori fonti industriali di emissioni globali di CO2, un fattore critico nella gestione e regolamentazione ambientale.
Fare la Scelta Giusta per il Tuo Obiettivo
Comprendere la calcinazione ti permette di riconoscere il suo ruolo specifico nella creazione dei materiali che modellano il nostro mondo.
- Se il tuo obiettivo principale è produrre cemento o calce: La calcinazione è il processo fondamentale utilizzato per decomporre il calcare (CaCO3) in calce viva reattiva (CaO) allontanando la CO2.
- Se il tuo obiettivo principale è preparare un catalizzatore o un adsorbente: La calcinazione viene utilizzata per rimuovere acqua e precursori volatili, creando un materiale puro ad alta superficie pronto per l'uso.
- Se il tuo obiettivo principale è rafforzare un pezzo in ceramica o polvere metallica: Stai pensando alla sinterizzazione, che compatta le particelle per aumentare la densità, non alla calcinazione che ne modifica la chimica.
In definitiva, la calcinazione è uno strumento fondamentale per alterare chimicamente un materiale solido utilizzando il calore per rilasciare i suoi componenti volatili.
Tabella Riepilogativa:
| Materiale di Calcinazione | Gas Sottoprodotto Comune | Prodotto Solido Primario |
|---|---|---|
| Calcare (CaCO₃) | Anidride Carbonica (CO₂) | Calce Viva (CaO) |
| Minerali Idrati (es. Bauxite, Gesso) | Vapore Acqueo (H₂O) | Ossido Anidro |
| Certi Solfati | Anidride Solforosa (SO₂) | Ossido Metallico |
Hai bisogno di una lavorazione termica precisa per i tuoi materiali?
La calcinazione è un passaggio critico nella produzione di qualsiasi cosa, dal cemento ai catalizzatori. KINTEK è specializzata in apparecchiature da laboratorio ad alta temperatura, inclusi forni ideali per processi di calcinazione controllati. Le nostre soluzioni ti aiutano a ottenere le esatte trasformazioni chimiche di cui hai bisogno, con un focus su efficienza e purezza.
Sia che tu stia sviluppando nuovi materiali, raffinando minerali o preparando catalizzatori, l'esperienza di KINTEK nelle apparecchiature da laboratorio può supportare la tua ricerca e sviluppo e il controllo qualità. Lasciaci aiutarti a ottimizzare i tuoi processi di decomposizione termica.
Contatta KINTEK oggi per discutere le tue specifiche esigenze di calcinazione e scoprire l'attrezzatura giusta per il tuo laboratorio.
Guida Visiva
Prodotti correlati
- Impianto di pirolisi a forno rotante elettrico Macchina Calcinatore Piccolo Forno Rotante Forno Rotante
- Fornace a Tubo Rotante a Lavoro Continuo Sottovuoto Fornace a Tubo Rotante
- Fornace a Pirolisi Continua Elettrica Rotante per Lavorazione Piccola Scala
- Fornace a Pirolisi per Biomassa Rotante Elettrica Piccola Fornace Rotante
- Fornace Rotante Elettrica per la Rigenerazione del Carbone Attivo
Domande frequenti
- Quali sono i prodotti della pirolisi del legno? Una guida alle rese di biochar, bio-olio e syngas
- Quali sono le applicazioni industriali della pirolisi? Trasformare i rifiuti in energia e prodotti di valore
- Quali sono i diversi tipi di reattori nella pirolisi della plastica? Scegli il sistema giusto per i tuoi rifiuti
- Quale biomassa viene utilizzata nella pirolisi? Selezione della materia prima ottimale per i tuoi obiettivi
- Quali sono le zone del forno rotativo nella produzione di cemento? Padroneggiare il processo principale per un clinker di alta qualità



















