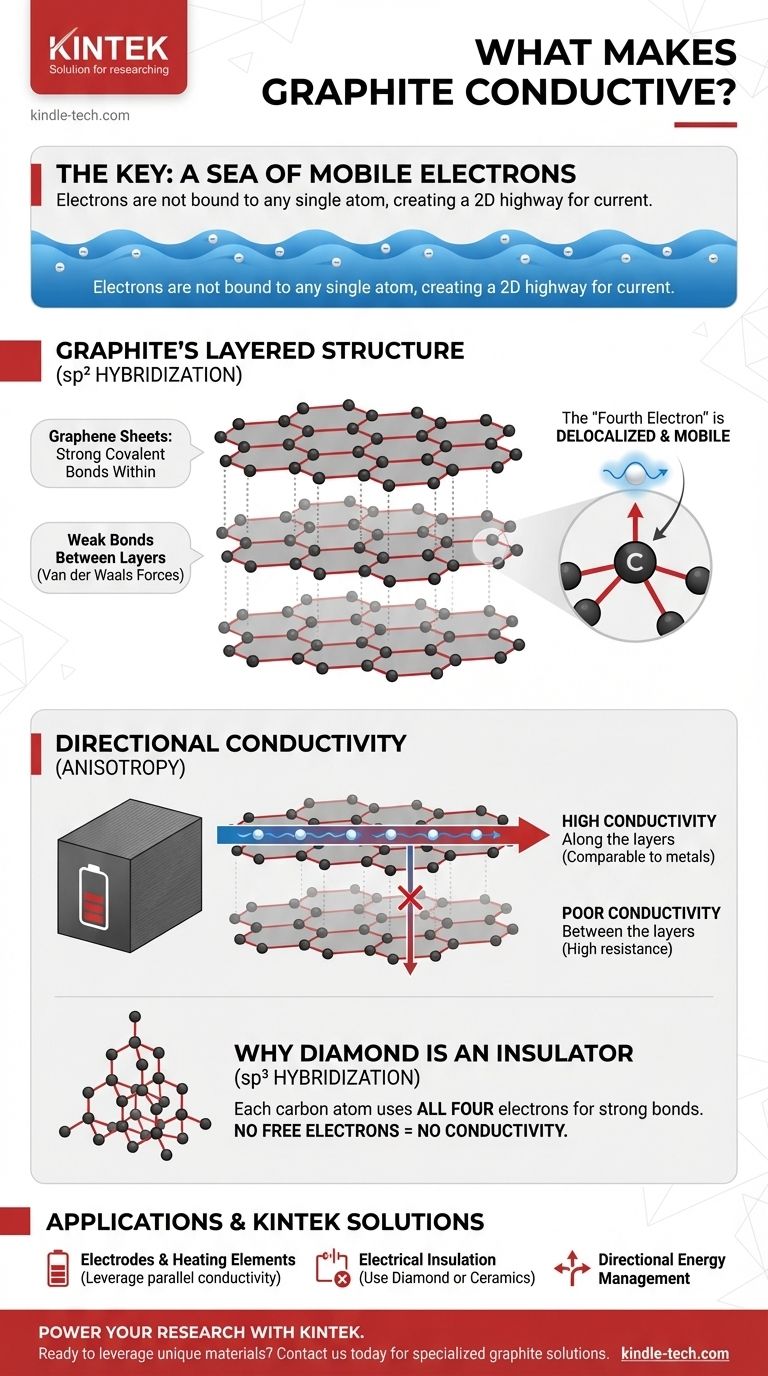
In sostanza, la conducibilità elettrica nella grafite è causata da un mare di elettroni mobili che non sono legati a un singolo atomo. Questo comportamento elettronico unico è il risultato diretto della specifica struttura atomica a strati della grafite e del modo in cui i suoi atomi di carbonio si legano tra loro.
L'intuizione cruciale è che mentre la maggior parte dei non metalli blocca i propri elettroni in posizione, la struttura unica a fogli della grafite lascia un elettrone per atomo libero di muoversi. Questo elettrone "delocalizzato" crea un'autostrada elettronica 2D, consentendo alla grafite di condurre elettricità in modo molto simile a un metallo.

Le Fondamenta: La Struttura a Strati della Grafite
Per comprendere il flusso di elettricità, dobbiamo prima visualizzare la forma fisica del materiale. La grafite non è un ammasso casuale di atomi; è un cristallo altamente organizzato.
Una Pila di Fogli di Grafene
La grafite è composta da innumerevoli strati di atomi di carbonio. Ogni singolo strato, noto come foglio di grafene, è un piano piatto e bidimensionale.
Legami Forti All'Interno, Legami Deboli Tra
All'interno di ogni foglio, gli atomi di carbonio sono disposti in un modello esagonale a nido d'ape, collegati da legami covalenti estremamente forti. Tuttavia, i legami che tengono insieme i fogli separati sono molto deboli (forze di van der Waals).
Il Ruolo dell'Elettrone: Svelare la Conducibilità
La natura specifica dei legami all'interno dei fogli di grafene è la vera fonte della conducibilità della grafite.
Il Legame di Ibridazione sp²
Ogni atomo di carbonio ha quattro elettroni nel guscio più esterno disponibili per il legame. Nella grafite, ogni atomo utilizza tre di questi elettroni per formare legami forti e piatti con i suoi tre vicini nel foglio esagonale.
Il "Quarto Elettrone" Crea un Mare di Mobilità
Questo lascia un elettrone per atomo di carbonio che non è coinvolto nella struttura di legame primaria. Questo elettrone occupa un tipo diverso di orbitale (orbitale p) e non è più legato al suo atomo originale.
Invece, questi "quarti elettroni" di tutti gli atomi in un foglio si fondono per formare un mare delocalizzato di elettroni. Questi elettroni sono liberi di muoversi ovunque attraverso l'intera superficie bidimensionale del loro foglio di grafene.
Come gli Elettroni Mobili Abilitano la Corrente
La corrente elettrica è semplicemente il flusso di carica. Quando viene applicata una tensione attraverso un pezzo di grafite, questa vasta riserva di elettroni mobili viene facilmente spinta lungo i fogli di grafene, creando una potente corrente elettrica.
Comprendere i Compromessi: Conducibilità Direzionale
La conducibilità della grafite non è uniforme in tutte le direzioni. Questa proprietà, nota come anisotropia, è una considerazione critica in qualsiasi applicazione pratica.
Alta Conducibilità Lungo gli Strati
L'elettricità fluisce eccezionalmente bene parallelamente ai fogli di grafene. Il mare di elettroni delocalizzati fornisce un percorso quasi senza ostacoli per la corrente, rendendo la conducibilità della grafite in questa direzione paragonabile a molti metalli.
Scarsa Conducibilità Tra gli Strati
Al contrario, è molto difficile per gli elettroni saltare da un foglio all'altro. L'ampio spazio e le forze deboli tra gli strati creano un'alta resistenza, rendendo la grafite un cattivo conduttore perpendicolarmente ai suoi strati.
Perché il Diamante Non è Conduttivo? Un Confronto Chiave
Per apprezzare appieno l'unicità della grafite, è utile confrontarla con il diamante, un'altra forma di carbonio puro.
Il Legame sp³ nel Diamante
Nel diamante, ogni atomo di carbonio utilizza tutti e quattro i suoi elettroni esterni per formare forti legami covalenti con quattro atomi vicini in un reticolo tridimensionale rigido.
Nessun Elettrone Libero, Nessuna Conducibilità
Poiché ogni elettrone è bloccato in un legame fisso e localizzato, non ci sono elettroni mobili disponibili per trasportare una corrente. Questo è il motivo per cui il diamante è uno degli isolanti elettrici più noti.
Come Applicare Questo al Tuo Obiettivo
Le proprietà uniche della conducibilità della grafite ne determinano l'uso in varie applicazioni.
- Se il tuo obiettivo principale è creare un elettrodo o un elemento riscaldante: Sfrutta l'eccellente conducibilità della grafite lungo i suoi piani, orientando il materiale in modo che la corrente scorra parallelamente ai fogli di grafene.
- Se il tuo obiettivo principale è l'isolamento elettrico: La grafite è la scelta sbagliata; è necessario un materiale come il diamante o una ceramica, poiché non hanno elettroni liberi.
- Se il tuo obiettivo principale è la gestione direzionale del calore o dell'elettricità: La natura anisotropa della grafite è un vantaggio, consentendoti di incanalare l'energia lungo un asse mentre isoli lungo un altro.
In definitiva, la grafite funge da esempio perfetto di come la struttura atomica di un materiale ne determini direttamente le proprietà più fondamentali.
Tabella Riassuntiva:
| Fattore Chiave | Ruolo nella Conducibilità |
|---|---|
| Ibridazione sp² | Crea un reticolo esagonale 2D, lasciando un elettrone per atomo delocalizzato. |
| Elettroni Delocalizzati | Formano un "mare" di portatori di carica mobili che possono muoversi liberamente all'interno di un foglio di grafene. |
| Struttura a Strati | Consente un'alta conducibilità lungo gli strati ma una scarsa conducibilità tra di essi (anisotropia). |
| Confronto con il Diamante (sp³) | Il diamante non ha elettroni liberi (tutti gli elettroni sono legati), rendendolo un isolante. |
Pronto a sfruttare le proprietà conduttive uniche della grafite nel tuo laboratorio?
In KINTEK, siamo specializzati in attrezzature e materiali di consumo di alta qualità per laboratori. Che tu abbia bisogno di grafite per elettrodi, elementi riscaldanti o applicazioni specializzate, i nostri materiali sono progettati per fornire prestazioni superiori e conducibilità direzionale.
Contattaci oggi stesso per discutere come le nostre soluzioni possono alimentare la tua ricerca e innovazione. Lascia che i nostri esperti ti aiutino a selezionare i materiali perfetti per le tue specifiche esigenze di laboratorio.
Contatta subito il nostro team →
Guida Visiva
Prodotti correlati
- Fornace di grafitazione sottovuoto verticale ad alta temperatura
- Fornace di Grafittizzazione Continua Sottovuoto di Grafite
- Fornace di grafitazione sottovuoto a temperatura ultra-elevata in grafite
- Fornace di Grafittizzazione per Film ad Alta Conducibilità Termica al Vuoto di Grafite
- Fornace a tubo da laboratorio ad alta temperatura da 1400℃ con tubo in allumina
Domande frequenti
- Perché la grafite è il miglior conduttore di calore? Comprendere la sua superiorità termica direzionale
- A quale temperatura può resistere la grafite? Sblocca il suo vero potenziale fino a 3000°C
- A cosa serve il forno a grafite? Raggiungere calore estremo fino a 3000°C in un ambiente controllato
- La grafite è usata come materiale refrattario? Scopri le sue impareggiabili prestazioni ad alta temperatura
- Qual è la resistenza alla temperatura della grafite? Svelare il suo potenziale ad alta temperatura nel tuo laboratorio



















