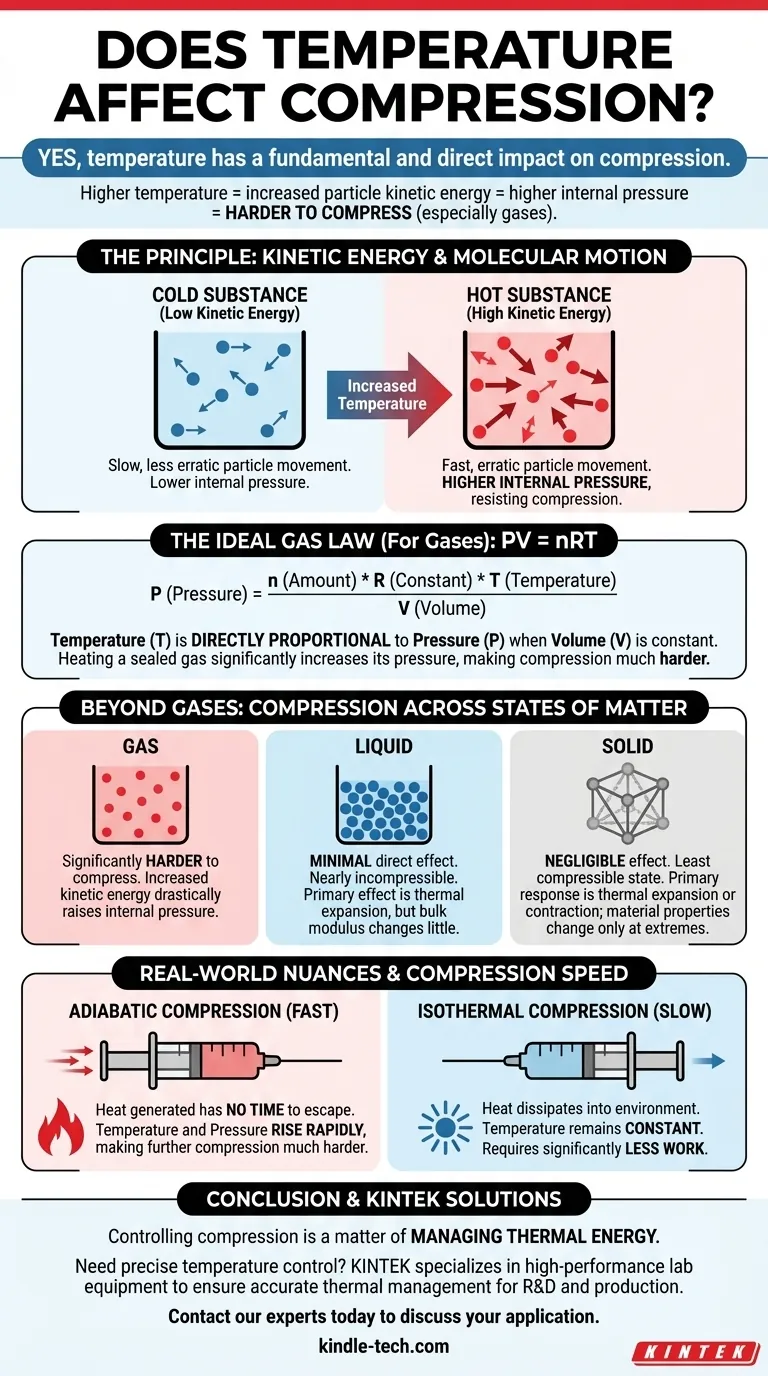
Sì, la temperatura ha un impatto fondamentale e diretto sulla compressione. Per i gas in particolare, quando si aumenta la temperatura di una sostanza, le sue particelle acquisiscono energia cinetica, si muovono più velocemente e spingono verso l'esterno con maggiore forza. Questa maggiore pressione interna rende la sostanza significativamente più difficile da comprimere.
Il principio fondamentale è una relazione diretta tra energia e pressione. Una temperatura più alta significa maggiore energia delle particelle, il che crea una pressione interna più elevata che è necessario vincere per comprimere una sostanza, specialmente un gas. Questa relazione è una pietra angolare della termodinamica.

Il Principio: Energia Cinetica e Movimento Molecolare
Per capire perché la temperatura influisce sulla compressione, dobbiamo esaminare cosa sta succedendo a livello molecolare.
Cosa Rappresenta la Temperatura
La temperatura non è una proprietà astratta; è una misura diretta dell'energia cinetica media degli atomi o delle molecole all'interno di una sostanza.
Le particelle più calde si muovono più velocemente e in modo più irregolare. Le particelle più fredde si muovono più lentamente.
Come l'Energia Cinetica Resiste alla Compressione
Quando si comprime una sostanza, si costringono le sue particelle ad avvicinarsi. L'energia cinetica di queste particelle crea una pressione interna che si oppone a questa forza esterna.
In un gas caldo, le particelle in rapido movimento collidono con le pareti del loro contenitore più frequentemente e con maggiore forza. Per ridurre il volume, è necessario applicare una forza esterna significativamente maggiore per vincere questa potente pressione interna.
Quantificare la Relazione: La Legge dei Gas Ideali
Per i gas, questa relazione è elegantemente descritta da un principio fondamentale in fisica e chimica.
La Formula: PV = nRT
La Legge dei Gas Ideali fornisce un modello matematico per il comportamento della maggior parte dei gas in condizioni comuni. La formula è PV = nRT, dove:
- P è la pressione
- V è il volume
- n è la quantità di gas
- R è la costante universale dei gas
- T è la temperatura
Ruolo Diretto della Temperatura
In questa equazione, la temperatura (T) è direttamente proporzionale alla pressione (P) se il volume è mantenuto costante.
Ciò significa che se si prende un contenitore sigillato di aria e lo si riscalda, la pressione interna aumenterà. Questa pressione aumentata è la resistenza che si avverte quando si tenta di comprimere un gas caldo.
Una Semplice Analogia: Una Pompa per Bicicletta
Quando si utilizza una pompa a mano per gonfiare uno pneumatico, si sta comprimendo rapidamente l'aria. Si noterà che il corpo della pompa si scalda.
Questo non è dovuto solo all'attrito. Si sta compiendo lavoro sul gas, il che aumenta la sua energia interna e quindi la sua temperatura. Questo effetto, noto come riscaldamento adiabatico, rende l'aria più difficile da comprimere man mano che si pompa più velocemente.
Oltre i Gas: Liquidi e Solidi
Sebbene l'effetto sia più marcato nei gas, la temperatura influenza anche la compressione di liquidi e solidi, sebbene in modi diversi.
Il Caso dei Liquidi
I liquidi sono considerati quasi incomprimibili. Le loro molecole sono già a stretto contatto, lasciando poco spazio libero.
L'effetto principale della temperatura su un liquido è l'espansione termica. Il riscaldamento di un liquido ne provoca una leggera espansione, ma la sua resistenza alla compressione (il suo modulo di compressibilità) non cambia in modo così drastico come accade per un gas.
Il Comportamento dei Solidi
I solidi sono lo stato della materia meno comprimibile. Come i liquidi, la loro risposta principale al cambiamento di temperatura è l'espansione o contrazione termica.
Sebbene temperature estreme possano influenzare le proprietà del materiale di un solido, come la rigidità, l'impatto diretto sulla sua comprimibilità è trascurabile nella maggior parte degli scenari ingegneristici rispetto all'effetto sui gas.
Errori Comuni e Sfumature del Mondo Reale
La Legge dei Gas Ideali è un modello potente, ma le applicazioni nel mondo reale presentano complessità importanti.
Gas Ideale contro Gas Reale
La Legge dei Gas Ideali presuppone che le particelle di gas non abbiano volume e non abbiano attrazioni intermolecolari. Questa è una semplificazione utile, ma i gas reali deviano da questo modello a pressioni molto elevate o temperature molto basse.
Compressione Adiabatica contro Isoterma
La velocità di compressione è immensamente importante.
- Compressione Adiabatica (Veloce): Quando si comprime un gas rapidamente, il calore generato non ha il tempo di fuoriuscire. Questo aumento di temperatura innalza la pressione interna, rendendo molto più difficile l'ulteriore compressione.
- Compressione Isoterma (Lenta): Se si comprime un gas molto lentamente, il calore può dissiparsi nell'ambiente, mantenendo la temperatura costante. Ciò richiede un lavoro significativamente inferiore rispetto alla compressione adiabatica.
Fare la Scelta Giusta per il Tuo Obiettivo
Il tuo approccio dipende interamente da ciò che stai cercando di ottenere.
- Se il tuo obiettivo principale è progettare un sistema pneumatico o idraulico: Devi gestire attivamente il calore. L'aumento di temperatura dovuto alla compressione rapida (riscaldamento adiabatico) aumenterà significativamente la forza richiesta e può influire sulle guarnizioni e sulla viscosità del fluido.
- Se il tuo obiettivo principale è gestire contenitori sigillati e pressurizzati: Devi tenere conto delle oscillazioni della temperatura ambiente. Un serbatoio riempito in una mattina fresca subirà un aumento di pressione significativo sotto il sole pomeridiano, il che può diventare un fattore critico di sicurezza.
- Se il tuo obiettivo principale è comprendere la fisica di base: Inizia con la Legge dei Gas Ideali (PV=nRT). È il modello essenziale per cogliere la relazione diretta e prevedibile tra temperatura, pressione e volume.
In definitiva, la temperatura è una forma di energia e controllare la compressione è una questione di gestione di tale energia.
Tabella Riassuntiva:
| Stato della Materia | Effetto dell'Aumento di Temperatura sulla Compressione | Principio Chiave |
|---|---|---|
| Gas | Significativamente più difficile da comprimere | Legge dei Gas Ideali (PV=nRT); l'aumento dell'energia cinetica innalza la pressione interna. |
| Liquido | Effetto minimo diretto sulla comprimibilità (quasi incomprimibile) | L'effetto principale è l'espansione termica; il modulo di compressibilità cambia poco. |
| Solido | Effetto trascurabile sulla comprimibilità nella maggior parte degli scenari | L'effetto principale è l'espansione/contrazione termica; le proprietà del materiale possono cambiare agli estremi. |
Hai bisogno di un controllo preciso della temperatura per i tuoi processi di compressione?
Comprendere la termodinamica della compressione è fondamentale per la ricerca e sviluppo (R&S), il controllo qualità e l'ottimizzazione dei processi. KINTEK è specializzata in apparecchiature da laboratorio ad alte prestazioni, inclusi forni, stufe e sistemi di controllo della temperatura, progettati per aiutarti a gestire accuratamente l'energia termica nei tuoi esperimenti e nella produzione.
Lascia che i nostri esperti ti aiutino a selezionare l'attrezzatura giusta per garantire risultati affidabili e ripetibili. Contatta oggi il nostro team tecnico per discutere le tue specifiche esigenze applicative.
Guida Visiva
Prodotti correlati
- Pressa Isostatica a Freddo Elettrica da Laboratorio CIP per Pressatura Isostatica a Freddo
- Presse Isostatica a Freddo per Laboratorio Automatico Macchina per Presse Isostatica a Freddo
- Macchina manuale per pressatura isostatica a freddo CIP per pellet
- Presse Isostatiche a Caldo WIP Stazione di Lavoro 300Mpa per Applicazioni ad Alta Pressione
- Pressa Idraulica Manuale Riscaldata ad Alta Temperatura con Piastre Riscaldate per Laboratorio
Domande frequenti
- Quanto costa una pressa isostatica? Una guida ai prezzi per laboratorio rispetto a quelli industriali
- Quali sono le applicazioni della pressatura isostatica a freddo? Ottenere una densità uniforme per componenti complessi
- Qual è il materiale dello stampo per la pressatura isostatica a freddo? Elastomeri essenziali per una densità uniforme
- Quali sono gli esempi di pressatura isostatica a freddo? Ottenere una densità uniforme nella compattazione delle polveri
- Quali sono gli svantaggi della metallurgia delle polveri? Limitazioni chiave in termini di resistenza e dimensioni



















