Il calore richiesto per la calcinazione non è un valore unico e universale. È una quantità variabile che dipende interamente dal materiale specifico in lavorazione, dalla reazione chimica sottostante e dall'efficienza dell'attrezzatura utilizzata, come un forno o un calcinatore. Il calcolo di questo valore richiede la comprensione sia dei principi chimici che delle inefficienze del sistema nel mondo reale.
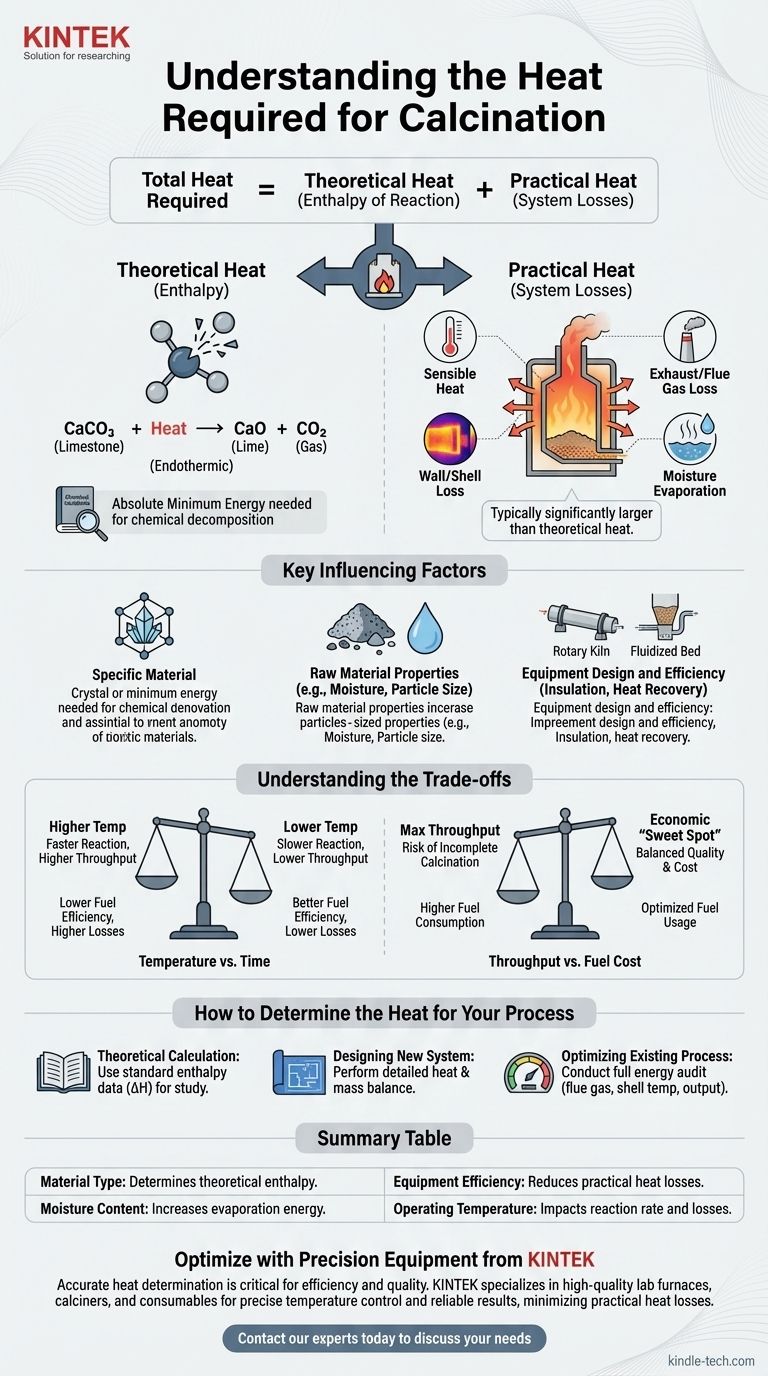
Il calore totale richiesto per qualsiasi processo di calcinazione è la somma di due componenti distinti: il calore teorico di reazione necessario per rompere i legami chimici del materiale e le perdite di calore pratiche inerenti al sistema operativo. Un'analisi di successo deve tenere conto di entrambi.

I due componenti del calore di calcinazione
Per comprendere le richieste energetiche della calcinazione, dobbiamo separare il minimo teorico dalle realtà pratiche delle attrezzature industriali.
Calore Teorico (Entalpia di Reazione)
Questa è la quantità minima assoluta di energia richiesta dalle leggi della chimica per avviare la reazione di decomposizione.
Questo valore è fisso per una data trasformazione chimica. Ad esempio, la calcinazione del calcare (carbonato di calcio, CaCO₃) per produrre calce (ossido di calcio, CaO) e anidride carbonica (CO₂) è una reazione endotermica, il che significa che deve assorbire una quantità specifica di energia per procedere.
Questo requisito energetico teorico può essere calcolato o trovato nei manuali di ingegneria chimica per la maggior parte dei materiali comuni.
Calore Pratico (Perdite di Sistema)
Questa è tutta l'energia aggiuntiva che deve essere fornita a un sistema reale oltre il minimo teorico. Nella maggior parte delle operazioni industriali, questa componente è significativamente più grande del calore teorico di reazione.
Le principali fonti di perdita di calore pratica includono:
- Calore Sensibile: Energia utilizzata per riscaldare il materiale stesso fino alla temperatura di reazione richiesta.
- Perdita di Gas di Scarico/Fumi: Calore trasportato via dai gas caldi che lasciano il calcinatore.
- Perdita di Parete/Guscio: Calore che si irradia e si convoglia dalle superfici esterne del forno o del forno.
- Evaporazione dell'Umidità: Energia consumata per trasformare l'acqua presente nella materia prima in vapore prima che la reazione di calcinazione possa anche solo iniziare.
Fattori chiave che influenzano il fabbisogno di calore
Il dato finale del consumo energetico è il risultato di diverse variabili interagenti. La comprensione di questi fattori è cruciale per la progettazione e l'ottimizzazione del processo.
Il Materiale Specifico
Materiali diversi hanno legami chimici e temperature di decomposizione molto diverse. L'energia necessaria per rimuovere l'acqua dal gesso è molto inferiore all'energia necessaria per decomporre il carbonato di calcio.
Proprietà della Materia Prima
Lo stato fisico del materiale è importante. Le polveri fini si riscaldano in modo più uniforme rispetto a grandi rocce, e un'elevata umidità iniziale può aumentare drasticamente il consumo energetico a causa dell'alto calore di vaporizzazione dell'acqua.
Progettazione ed Efficienza dell'Attrezzatura
Il tipo di attrezzatura utilizzata, come un forno rotante, un forno a pozzo o un calcinatore a letto fluidizzato, ha un impatto enorme sul trasferimento di calore.
Fattori come la qualità dell'isolamento, l'efficacia delle guarnizioni d'aria e la presenza di sistemi di recupero del calore (come i preriscaldatori che utilizzano gas di scarico caldi per riscaldare il materiale in ingresso) sono i principali motori dell'efficienza termica complessiva.
Comprendere i compromessi
L'ottimizzazione di un processo di calcinazione implica il bilanciamento di obiettivi operativi concorrenti. Ignorare questi compromessi spesso porta a inefficienze o a una scarsa qualità del prodotto.
Temperatura vs. Tempo
Temperature operative più elevate possono accelerare la reazione di calcinazione, aumentando la produttività. Tuttavia, ciò spesso comporta maggiori perdite di calore attraverso il guscio dell'attrezzatura e i gas di scarico, riducendo l'efficienza del combustibile.
Al contrario, temperature più basse conservano energia ma richiedono che il materiale trascorra più tempo nel calcinatore, il che può limitare il tasso di produzione.
Produzione vs. Costo del Carburante
Spingere per la massima produzione può portare a una calcinazione incompleta o richiedere l'immissione di così tanto combustibile nel sistema che l'efficienza complessiva crolla.
Trovare il "punto ottimale" economico richiede un attento bilanciamento del valore del prodotto finale rispetto al costo del combustibile consumato per tonnellata.
Come determinare il calore per il tuo processo
Non esiste una formula unica, ma è possibile determinare il fabbisogno di calore concentrandosi sul proprio obiettivo specifico.
- Se il tuo obiettivo principale è un calcolo teorico per lo studio: Trova l'entalpia standard di reazione (ΔH) per la tua specifica decomposizione chimica in un riferimento di dati termodinamici.
- Se il tuo obiettivo principale è la progettazione di un nuovo sistema: Devi eseguire un bilancio dettagliato di calore e massa che tenga conto delle proprietà del materiale, delle specifiche dell'attrezzatura e di tutte le potenziali perdite di calore.
- Se il tuo obiettivo principale è l'ottimizzazione di un processo esistente: Conduci un audit energetico completo sulla tua attrezzatura, misurando le temperature dei gas di scarico, la produzione del prodotto e le temperature del guscio per identificare e quantificare le principali fonti di perdita di calore.
In definitiva, la determinazione accurata del calore di calcinazione va oltre un singolo numero per arrivare a un'analisi completa del tuo materiale e sistema specifici.
Tabella riassuntiva:
| Fattore | Impatto sul Fabbisogno di Calore |
|---|---|
| Tipo di Materiale | Determina l'entalpia teorica di reazione (es. calcare vs. gesso). |
| Contenuto di Umidità | Un'elevata umidità aumenta significativamente l'energia necessaria per l'evaporazione. |
| Efficienza dell'Attrezzatura | Un migliore isolamento e sistemi di recupero del calore riducono le perdite di calore pratiche. |
| Temperatura Operativa | Temperature più elevate possono aumentare la velocità di reazione ma anche le perdite di calore. |
Ottimizza il tuo processo di calcinazione con attrezzature di precisione da KINTEK.
Determinare accuratamente i requisiti di calore è fondamentale per l'efficienza e la qualità del prodotto. Sia che tu stia progettando un nuovo sistema o ottimizzandone uno esistente, la giusta attrezzatura da laboratorio è essenziale per un'analisi termica e test sui materiali accurati.
KINTEK è specializzata in forni da laboratorio, calcinatori e materiali di consumo di alta qualità che forniscono il controllo preciso della temperatura e l'affidabilità necessari per la tua ricerca e lo sviluppo di processi. Le nostre soluzioni ti aiutano a minimizzare le perdite di calore pratiche e a ottenere risultati ottimali.
Contatta i nostri esperti oggi per discutere le tue specifiche esigenze di calcinazione e scoprire come KINTEK può migliorare le capacità del tuo laboratorio.
Guida Visiva
Prodotti correlati
- Fornace a muffola da 1800℃ per laboratorio
- Fornace a muffola da 1700℃ per laboratorio
- Fornace a muffola con sollevamento inferiore per laboratorio
- Fornace a muffola da 1400℃ per laboratorio
- Fornace a tubo da laboratorio ad alta temperatura da 1400℃ con tubo in allumina
Domande frequenti
- Qual è l'alta temperatura di un forno rotante? Ottieni un riscaldamento uniforme superiore per polveri e granuli
- Quali sono i diversi tipi di tecnologia di pirolisi? Scegli il processo giusto per il tuo obiettivo di output
- Qual è lo scopo del calcinatore? Aumentare l'efficienza della produzione di cemento e la formazione del clinker
- In che modo la pirolisi aiuta l'ambiente? Trasformare i rifiuti in energia rinnovabile e sequestro del carbonio
- Quali sono i vantaggi dell'utilizzo di un reattore rotante per ALD su polveri di rame? Rivestimento superiore per materiali coesivi
- Cos'è il processo di pirolisi flash? Massimizzare la resa di bio-olio liquido da biomassa e plastica
- Qual è la funzione di un forno rotante e dell'iniezione di gas argon? Ottimizzare la carbonizzazione della lolla di riso per rese elevate
- Qual è la resa di biochar nella pirolisi? Controlla il tuo risultato dal 10% al 30%+



















