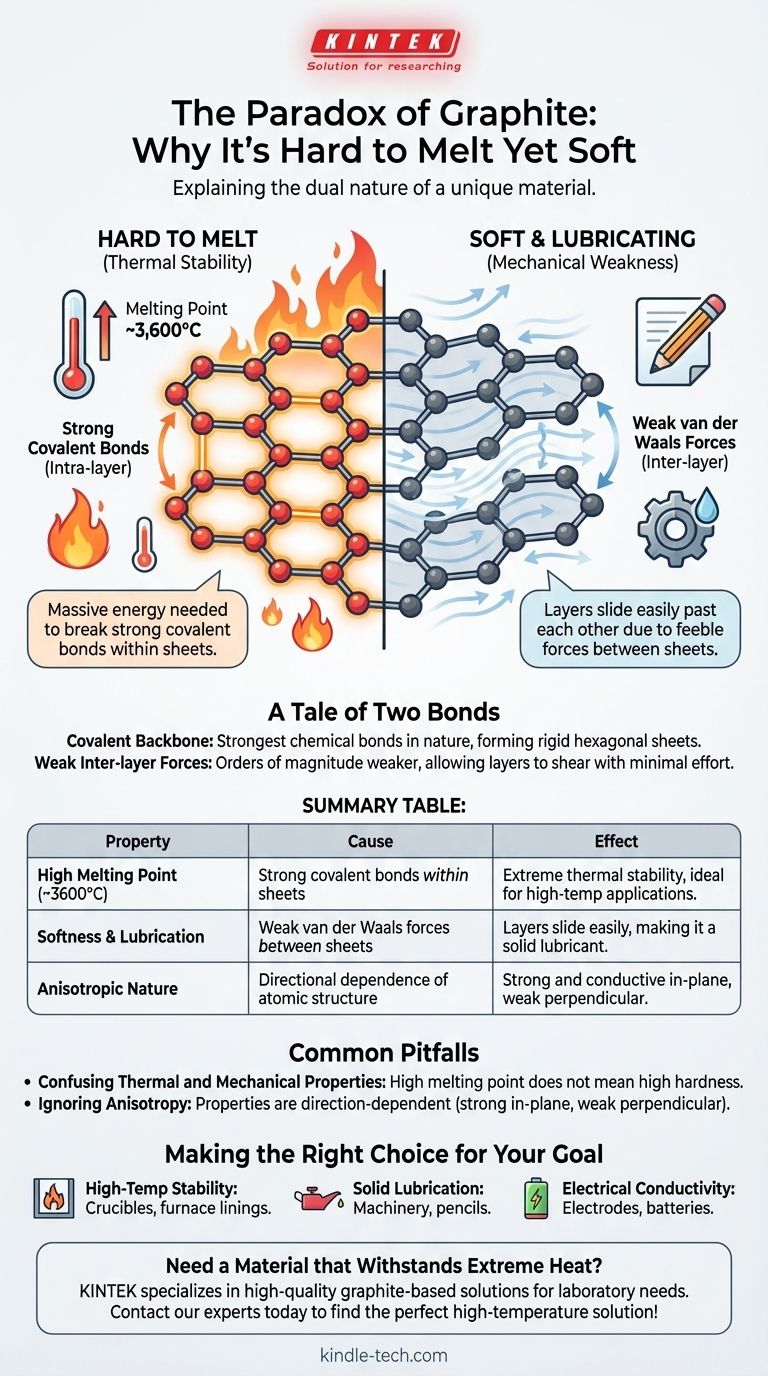
Il paradosso della grafite risiede nella sua duplice natura: è uno dei materiali più teneri conosciuti, eppure possiede uno dei punti di fusione più alti. Questo comportamento deriva dalla sua unica struttura atomica, in cui gli atomi di carbonio sono tenuti insieme da legami covalenti immensamente forti all'interno di fogli piatti, richiedendo una quantità enorme di energia per rompere e fondere la sostanza.
Le proprietà della grafite sono un racconto di due forze. L'estrema forza dei legami covalenti all'interno dei suoi strati atomici determina il suo alto punto di fusione, mentre la profonda debolezza delle forze tra quegli strati spiega perché risulta morbida e agisce come lubrificante.

Un Racconto di Due Legami: L'Origine della Forza della Grafite
La resistenza alla fusione della grafite è radicata nel modo fondamentale in cui sono connessi i suoi atomi di carbonio. Questa architettura interna è incredibilmente robusta.
L'Impalcatura Covalente
Ogni atomo di carbonio in un foglio di grafite è legato ad altri tre tramite legami covalenti. Questi legami, che comportano la condivisione di elettroni tra atomi, sono tra i tipi di legami chimici più forti in natura.
Per fondere una sostanza, è necessario fornire sufficiente energia termica per rompere i legami che tengono i suoi atomi in una struttura solida e fissa. Poiché i legami covalenti della grafite sono così forti, l'energia necessaria per distruggerli è immensa, risultando in un punto di fusione di circa 3.600°C (6.500°F).
I Fogli Esagonali
Questi atomi legati covalentemente formano vasti fogli piatti disposti in un reticolo esagonale simile a un nido d'ape. Si può pensare a ogni foglio come a un singolo strato del materiale meraviglioso che è il grafene.
All'interno di questi fogli, la struttura è rigida ed eccezionalmente stabile. La forza non è solo in una direzione; è distribuita sull'intera superficie bidimensionale.
Risolvere il Paradosso: Perché è Anche Morbida?
La spiegazione della morbidezza della grafite si trova non all'interno dei suoi forti fogli atomici, ma nello spazio tra di essi.
Deboli Forze Inter-strato
Mentre gli atomi all'interno di un foglio sono legati potentemente, i fogli stessi sono impilati l'uno sull'altro con pochissimo che li tenga insieme. Sono attratti solo da deboli forze intermolecolari note come forze di van der Waals.
Queste forze sono ordini di grandezza più deboli dei legami covalenti all'interno dei fogli.
Gli Strati Scorrevoli
Poiché l'attrazione tra gli strati è così debole, i fogli possono scivolare facilmente l'uno sull'altro con il minimo sforzo. Questa azione di scorrimento è ciò che percepiamo come morbidezza e ciò che rende la grafite un eccellente lubrificante solido.
Quando si scrive con una matita, si stanno semplicemente tranciando migliaia di questi strati debolmente collegati e depositandoli sulla carta.
Intra-strato contro Inter-strato
Questa distinzione è la chiave per comprendere la grafite. Le forze intra-strato (legami covalenti) sono incredibilmente forti, conferendo alla grafite la sua stabilità termica. Le forze inter-strato (van der Waals) sono incredibilmente deboli, conferendole morbidezza meccanica.
Errori Comuni da Evitare
Comprendere la grafite significa evitare la comune semplificazione secondo cui un materiale è o "forte" o "debole". Le sue proprietà dipendono fortemente dal contesto e dalla direzione.
Confondere Proprietà Termiche e Meccaniche
È un errore comune presumere che un alto punto di fusione debba correlarsi con un'elevata durezza meccanica. La grafite è il classico controesempio.
La sua stabilità termica (resistenza alla fusione) è governata dai suoi forti legami covalenti. Le sue proprietà meccaniche (morbidezza e resistenza al taglio) sono governate dalle sue deboli forze inter-strato.
Ignorare l'Anisotropia
La grafite è un materiale altamente anisotropo, il che significa che le sue proprietà dipendono dalla direzione.
È estremamente forte e conduce calore ed elettricità bene lungo il piano dei suoi fogli atomici. Tuttavia, è meccanicamente debole e un cattivo conduttore perpendicolarmente a quei fogli.
Fare la Scelta Giusta per il Tuo Obiettivo
Questa duplice natura rende la grafite un materiale eccezionalmente versatile, ma la sua applicazione deve essere allineata con le sue specifiche proprietà direzionali.
- Se il tuo obiettivo principale è la stabilità ad alta temperatura: La grafite è un'ottima scelta per applicazioni come crogioli o rivestimenti di forni perché i suoi forti legami covalenti resistono alla decomposizione termica.
- Se il tuo obiettivo principale è la lubrificazione solida: Gli strati scorrevoli e debolmente legati della grafite la rendono ideale per ridurre l'attrito nei macchinari, nelle serrature o come "mina" nelle matite.
- Se il tuo obiettivo principale è la conducibilità elettrica: La struttura consente agli elettroni di muoversi liberamente lungo i fogli, rendendo la grafite un materiale utile per elettrodi, batterie e spazzole nei motori elettrici.
Riconoscere che le proprietà macroscopiche di un materiale sono un risultato diretto della sua struttura atomica è la chiave per risolvere qualsiasi sfida ingegneristica.
Tabella Riassuntiva:
| Proprietà | Causa | Effetto |
|---|---|---|
| Alto Punto di Fusione (~3600°C) | Forti legami covalenti all'interno dei fogli atomici | Estrema stabilità termica, ideale per applicazioni ad alta temperatura |
| Morbidezza e Lubrificazione | Deboli forze di van der Waals tra i fogli | Gli strati scivolano facilmente, rendendola un lubrificante solido |
| Natura Anisotropa | Dipendenza direzionale della struttura atomica | Forte e conduttiva nel piano, debole perpendicolarmente ad esso |
Hai bisogno di un materiale che resista al calore estremo?
Le proprietà uniche della grafite la rendono una scelta ideale per forni ad alta temperatura, crogioli e altre attrezzature da laboratorio esigenti. In KINTEK, siamo specializzati nella fornitura di attrezzature e materiali di consumo da laboratorio di alta qualità, comprese soluzioni a base di grafite, per soddisfare le tue specifiche esigenze di laboratorio.
Contatta oggi i nostri esperti per trovare la soluzione ad alta temperatura perfetta per la tua applicazione!
Guida Visiva
Prodotti correlati
- Fornace di grafitazione sottovuoto a temperatura ultra-elevata in grafite
- Fornace di grafitazione sottovuoto verticale ad alta temperatura
- Fornace di Grafittizzazione Continua Sottovuoto di Grafite
- Fornace di Grafittizzazione per Film ad Alta Conducibilità Termica al Vuoto di Grafite
- Fornace a tubo da laboratorio ad alta temperatura da 1400℃ con tubo in allumina
Domande frequenti
- Perché la grafite ha un'elevata conducibilità termica? Sblocca una gestione del calore superiore con la sua struttura unica
- Qual è la densità della grafite? Un indicatore chiave di prestazioni e qualità
- Cosa rende la grafite speciale? Svelare le sue proprietà uniche per applicazioni estreme
- A quale temperatura fonde la grafite? Comprendere il suo estremo cambiamento di fase
- Come funziona un forno a induzione per la grafitazione nel facilitare la trasformazione del carbonio incombusto in grafite sintetica?



















