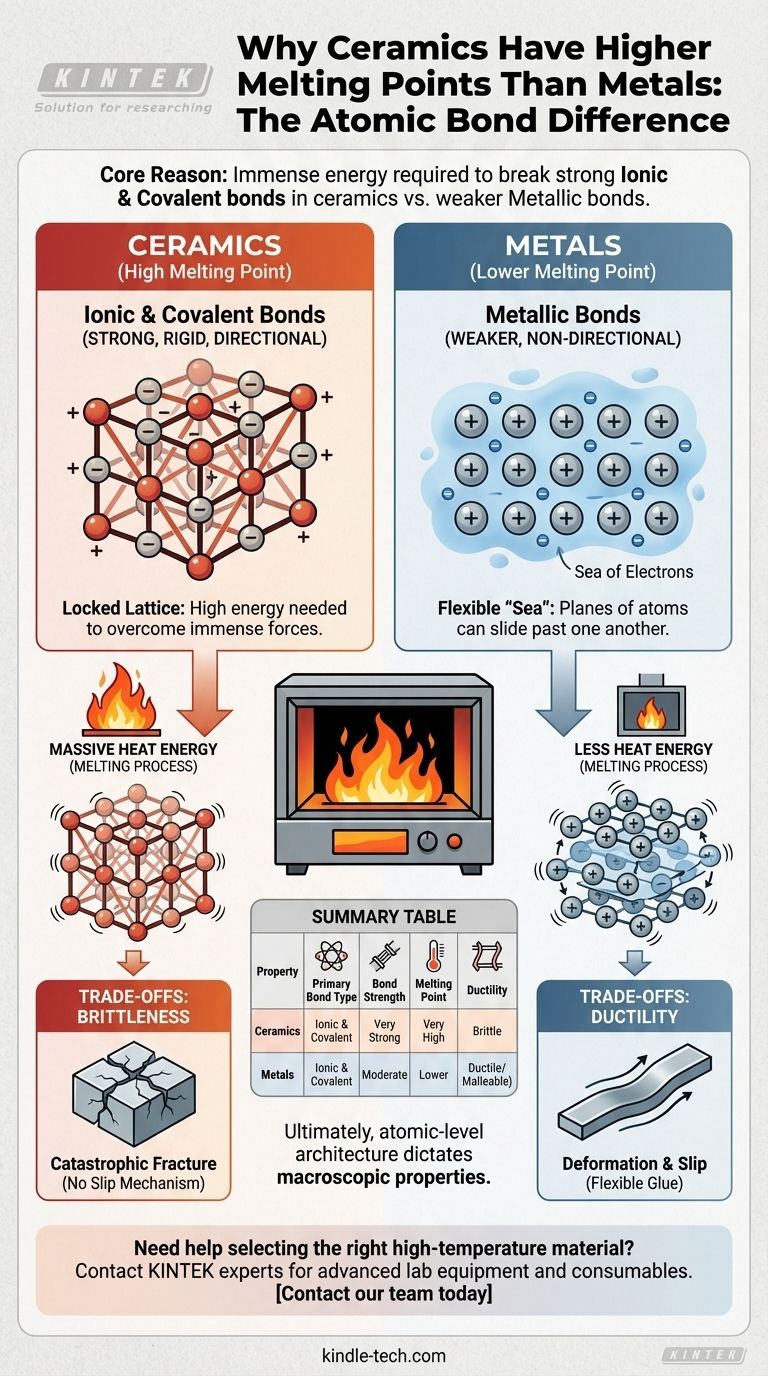
In sostanza, l'enorme differenza nella temperatura di fusione tra ceramiche e la maggior parte dei metalli dipende dalla natura fondamentale dei loro legami atomici. Le ceramiche sono tenute insieme da legami ionici e covalenti estremamente forti, che richiedono una quantità enorme di energia per essere rotti, mentre i metalli sono tenuti insieme da legami metallici deboli e non direzionali.
Il principio fondamentale è semplice: il punto di fusione di un materiale è una misura diretta dell'energia necessaria per rompere i legami che tengono uniti i suoi atomi. I potenti legami ionici e covalenti nelle ceramiche creano una struttura rigida e stabile che richiede molta più energia termica per essere smantellata rispetto al "mare di elettroni" flessibile che definisce i legami metallici.

La Differenza Fondamentale: Il Legame Atomico
Per comprendere le proprietà termiche, dobbiamo prima capire come gli atomi si collegano tra loro. Il tipo e la forza di queste connessioni sono i fattori principali che determinano il punto di fusione di un materiale.
Legami Metallici: Un "Mare" di Elettroni
Nei metalli, gli elettroni esterni degli atomi non sono legati a un singolo atomo. Invece, formano un "mare" di elettroni delocalizzato che fluisce liberamente attorno a un reticolo fisso di ioni metallici positivi.
Questa disposizione crea una forte forza coesiva, ma i legami sono non direzionali. Ciò consente ai piani di atomi di scivolare l'uno sull'altro senza un cedimento catastrofico, motivo per cui i metalli sono duttili e malleabili.
Legami Ionici: Una Potente Attrazione
Molte ceramiche sono formate da legami ionici, che si verificano tra ioni caricati positivamente (cationi) e ioni caricati negativamente (anioni). Un esempio classico è un ossido metallico.
La potente attrazione elettrostatica tra queste cariche opposte crea legami molto forti, rigidi e direzionali. Questo blocca gli ioni in un reticolo cristallino altamente stabile.
Legami Covalenti: La Coppia Condivisa
Altre ceramiche, come il carburo di silicio, sono definite da legami covalenti. Qui, gli atomi condividono elettroni per formare coppie di elettroni stabili, creando collegamenti eccezionalmente forti e altamente direzionali.
Questo tipo di legame dà origine ad alcuni dei materiali più duri e resistenti al calore conosciuti, poiché rompere queste coppie condivise richiede una quantità tremenda di energia.
Ceramiche: Un Ibrido di Forza
È fondamentale notare che la maggior parte delle ceramiche avanzate presenta una miscela di carattere ionico e covalente. Questa combinazione produce una struttura atomica con un'energia di legame eccezionalmente elevata, creando un'impalcatura rigida che è incredibilmente resistente alle vibrazioni atomiche indotte dal calore.
Come la Struttura Determina la Stabilità Termica
Il legame determina la struttura atomica, e tale struttura determina come il materiale si comporta quando viene riscaldato.
Fusione: Il Processo di Rottura di un Reticolo
La fusione è il processo di fornitura di energia termica sufficiente per consentire agli atomi o agli ioni di liberarsi dalle loro posizioni fisse nel reticolo cristallino. Il calore è semplicemente vibrazione atomica; maggiore è la temperatura, più violentemente vibrano gli atomi.
Perché i Legami Più Forti Richiedono Più Energia
Per rompere il reticolo rigido e direzionalmente bloccato di una ceramica, i suoi atomi devono vibrare con intensità sufficiente per superare le immense forze ioniche e covalenti che li tengono in posizione. Ciò richiede una temperatura molto elevata.
Al contrario, la natura delocalizzata e non direzionale dei legami metallici consente di interrompere il reticolo con un'energia termica significativamente inferiore.
Comprendere i Compromessi
Questa elevata stabilità termica nelle ceramiche non è priva di compromessi. La natura del legame che fornisce resistenza introduce anche limitazioni significative.
La Forza Ha un Costo: Fragilità
Gli stessi legami forti e direzionali che conferiscono alle ceramiche il loro alto punto di fusione le rendono anche fragili. Quando una ceramica è sottoposta a sollecitazioni, non esiste un meccanismo semplice per far scorrere gli atomi l'uno sull'altro.
Invece, i legami rigidi si fratturano catastroficamente. Qualsiasi piccola fessura concentra la sollecitazione e si propaga attraverso il materiale con un apporto energetico molto ridotto.
Il Vantaggio dei Metalli: Duttilità
Il "mare di elettroni" nei metalli agisce come una colla flessibile. Consente ai piani atomici di scivolare e deformarsi sotto sollecitazione senza rompere la coesione complessiva del materiale.
Questa proprietà, nota come duttilità, è un compromesso diretto per legami più deboli e, di conseguenza, punti di fusione più bassi.
Fare la Scelta Giusta per la Tua Applicazione
Comprendere queste differenze fondamentali è fondamentale per la selezione dei materiali in qualsiasi contesto ingegneristico.
- Se la tua priorità principale è l'integrità strutturale ad alta temperatura: Le ceramiche sono la scelta inequivocabile grazie all'eccezionale stabilità termica conferita dai loro forti legami ionici e covalenti.
- Se la tua priorità principale è la tenacità, la formabilità e la resistenza alla frattura: I metalli sono l'opzione superiore, poiché i loro legami metallici non direzionali consentono la deformazione piuttosto che il cedimento catastrofico.
- Se hai bisogno di un equilibrio di proprietà: Considera materiali avanzati come i compositi ceramico-metallici (cermet), progettati per combinare la durezza delle ceramiche con la tenacità dei metalli.
In definitiva, le proprietà macroscopiche di un materiale sono un riflesso diretto della sua architettura a livello atomico.
Tabella Riassuntiva:
| Proprietà | Ceramiche | Metalli |
|---|---|---|
| Tipo di Legame Primario | Ionico e Covalente | Metallico |
| Forza del Legame | Molto Forte | Moderata |
| Punto di Fusione | Molto Alto | Più Basso |
| Duttilità | Fragile | Duttile/Malleabile |
Hai bisogno di aiuto per selezionare il materiale ad alta temperatura giusto per la tua applicazione? In KINTEK, siamo specializzati nella fornitura di apparecchiature da laboratorio avanzate e materiali di consumo per test e ricerca sui materiali. Sia che tu stia lavorando con ceramiche ad alto punto di fusione o con metalli duttili, i nostri esperti possono aiutarti a scegliere la soluzione perfetta per le esigenze del tuo laboratorio. Contatta oggi il nostro team per discutere come possiamo supportare la tua ricerca e garantire prestazioni ottimali!
Guida Visiva
Prodotti correlati
- Fornace a muffola con sollevamento inferiore per laboratorio
- Fornace a muffola da 1800℃ per laboratorio
- Fornace a muffola da 1400℃ per laboratorio
- Fornace a muffola da 1700℃ per laboratorio
- Fornace a tubo da laboratorio ad alta temperatura da 1400℃ con tubo in allumina
Domande frequenti
- Qual è la ceramica più resistente? Il carburo di silicio primeggia per durezza e resistenza termica
- Qual è il limite di temperatura per l'allumina? Non è un numero singolo, ecco perché.
- Le ceramiche sono chimicamente non reattive? Scopri la loro notevole resistenza alla corrosione
- Ci sono svantaggi delle ceramiche? Il compromesso tra durezza e fragilità
- Qual è l'effetto della temperatura di sinterizzazione sulla densità e sulla durezza? Ottimizza le proprietà del tuo materiale
- Che tipo di solido è il SiC? Svelare i segreti della sua struttura a rete covalente
- Qual è la temperatura massima di utilizzo dell'allumina? Sblocca prestazioni termiche elevate per il tuo laboratorio
- Come funziona il carburo di silicio? Alimentare l'elettronica di nuova generazione con efficienza estrema



















