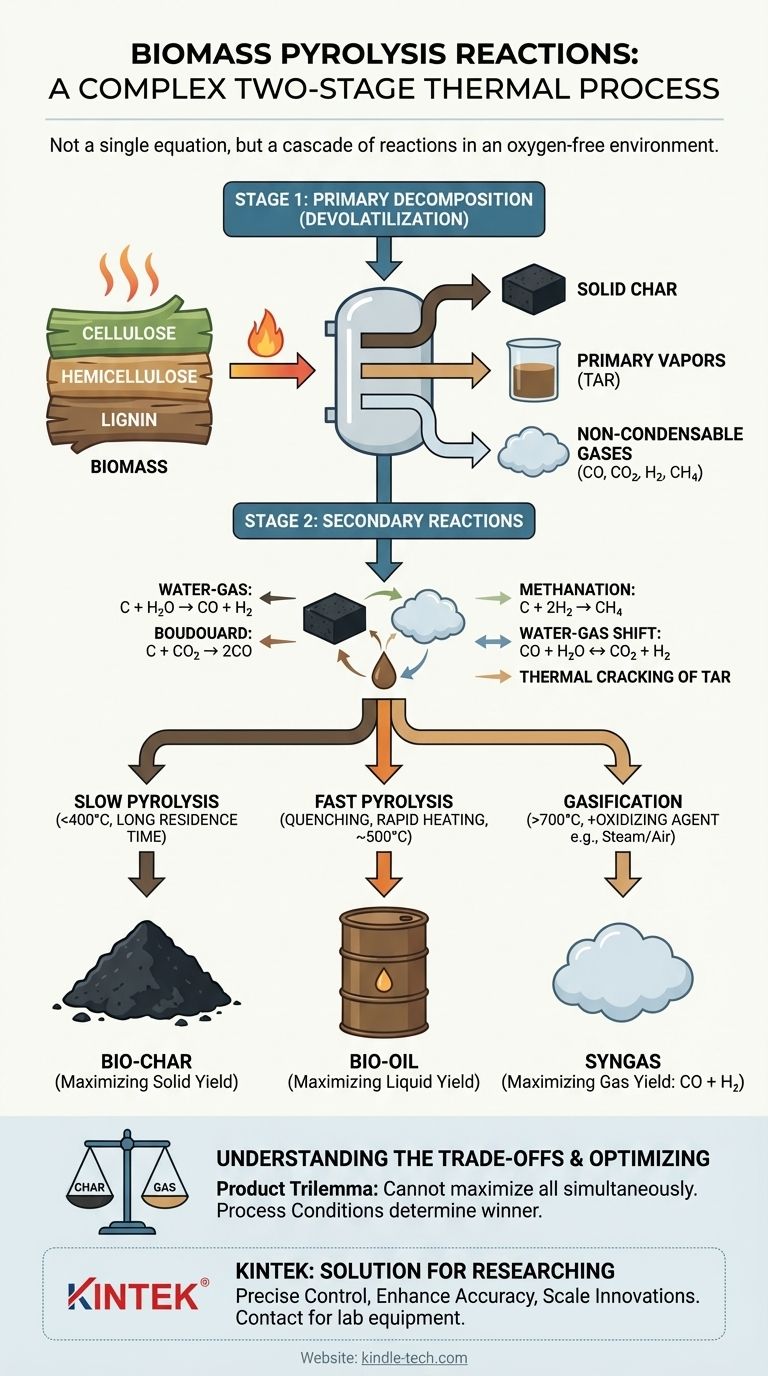
In sostanza, la pirolisi della biomassa non è una singola reazione chimica ma un complesso processo termico a due stadi. In primo luogo, il calore scompone i grandi polimeri organici della biomassa in un ambiente privo di ossigeno (un processo chiamato devolatilizzazione), creando una miscela di carbone solido, vapori liquidi (catrame) e gas. Questi prodotti iniziali subiscono quindi una serie di reazioni secondarie, reagendo tra loro per formare i prodotti finali stabili di bio-carbone, bio-olio e syngas.
La pirolisi è meglio intesa come una cascata di reazioni, non una singola equazione. La rottura termica iniziale della biomassa è seguita da reazioni secondarie che coinvolgono il carbone e i vapori risultanti. Le rese finali dei prodotti—carbone, olio o gas—sono determinate interamente da quali di questi percorsi di reazione secondaria sono favoriti dalle condizioni di processo come la temperatura e la velocità di riscaldamento.

I due stadi delle reazioni di pirolisi
Per comprendere la pirolisi, è necessario separare il processo in due stadi distinti ma interconnessi. Il primo è la scomposizione iniziale della biomassa solida, e il secondo è la successiva trasformazione dei prodotti risultanti.
Stadio 1: Decomposizione primaria (Devolatilizzazione)
Questa è la "rottura" termica iniziale della biomassa stessa. L'energia termica rompe i legami chimici all'interno dei componenti primari della biomassa: cellulosa, emicellulosa e lignina.
Questo stadio non è rappresentato da una semplice equazione chimica. È una complessa rete di reazioni di decomposizione simultanee che convertono la biomassa solida in tre prodotti primari:
- Carbone solido: Il residuo solido ricco di carbonio lasciato indietro.
- Vapori primari: Un aerosol condensabile di liquidi, spesso chiamato catrame o precursori del bio-olio.
- Gas non condensabili: Gas leggeri come CO, CO₂, H₂ e CH₄.
Stadio 2: Reazioni secondarie
Una volta formati i prodotti primari, essi continuano a reagire nell'ambiente caldo del reattore. Queste reazioni secondarie sono ciò che determina in ultima analisi la composizione e la resa finale dei vostri prodotti. Le più importanti di queste coinvolgono il carbone caldo che reagisce con i gas e i vapori prodotti nello Stadio 1.
Le principali reazioni secondarie includono:
- Reazione acqua-gas:
C (carbone) + H₂O (vapore) → CO + H₂ - Reazione di Boudouard:
C (carbone) + CO₂ → 2CO - Metanazione:
C (carbone) + 2H₂ → CH₄ - Spostamento acqua-gas:
CO + H₂O ↔ CO₂ + H₂
Inoltre, i vapori di catrame pesanti possono subire cracking termico ad alte temperature, scomponendosi in gas più leggeri e non condensabili e depositando più carbonio sul carbone.
Come le condizioni di processo dettano il risultato
Il "vincitore" della competizione tra queste reazioni è determinato dalle condizioni di processo. Controllando la temperatura, la velocità di riscaldamento e il tempo di residenza, è possibile orientare il processo per massimizzare la resa di carbone, liquido o gas.
Pirolisi lenta (Focus sul bio-carbone)
Nella pirolisi lenta, basse temperature (<400°C) e lente velocità di riscaldamento danno alle reazioni secondarie ampio tempo per verificarsi. Questo ambiente favorisce le reazioni di formazione del carbone e permette ad alcuni vapori di ri-polimerizzare in un solido, massimizzando la resa di bio-carbone.
Pirolisi rapida (Focus sul bio-olio)
Nella pirolisi rapida, alte temperature e velocità di riscaldamento estremamente rapide scompongono la biomassa quasi istantaneamente. I vapori risultanti vengono immediatamente rimossi e raffreddati (quenched) per arrestare le reazioni secondarie. Questo "congela" il processo allo stadio intermedio, massimizzando la raccolta di vapori condensabili come bio-olio.
Gassificazione (Focus sul syngas)
È fondamentale distinguere la pirolisi dalla gassificazione. Mentre la pirolisi avviene in completa assenza di ossigeno, la gassificazione comporta l'introduzione intenzionale di un agente reattivo come ossigeno, vapore o aria.
Questa introduzione di un agente ossidante ad alte temperature promuove reazioni che producono gas come la combustione parziale (C + ½O₂ → CO) e le reazioni acqua-gas mostrate sopra. Questo sposta fondamentalmente l'obiettivo verso la massimizzazione della resa di syngas (CO + H₂).
Comprendere i compromessi
La chimica della pirolisi presenta un inevitabile "trilemma del prodotto": non è possibile massimizzare contemporaneamente la resa di carbone, olio e gas da un singolo processo.
Il conflitto intrinseco del prodotto
L'ottimizzazione per un prodotto avviene a scapito degli altri. Un lungo tempo di residenza che favorisce la formazione di carbone distruggerà le rese liquide poiché i vapori si rompono o ripolimerizzano. Un rapido raffreddamento per salvare il bio-olio impedisce alle reazioni secondarie di formazione di gas di procedere completamente.
La complessità della biomassa
La biomassa non è una sostanza chimica uniforme. I suoi componenti—cellulosa, emicellulosa e lignina—si decompongono a temperature diverse e producono prodotti intermedi diversi. Questa variabilità intrinseca significa che il controllo preciso e la previsione dei percorsi di reazione rimangono una sfida tecnica significativa.
Ottimizzare le reazioni per il tuo obiettivo
La scelta delle condizioni di pirolisi deve essere guidata dal prodotto finale desiderato. Le reazioni sottostanti forniscono una chiara tabella di marcia su come raggiungere il tuo obiettivo.
- Se il tuo obiettivo principale è massimizzare il bio-carbone: Utilizza la pirolisi lenta con temperature più basse (~400°C) e lunghi tempi di residenza per favorire la formazione di solidi.
- Se il tuo obiettivo principale è massimizzare il bio-olio: Utilizza la pirolisi rapida con velocità di riscaldamento rapide (>100°C/s), temperature moderate (~500°C) e brevi tempi di residenza dei vapori seguiti da un rapido raffreddamento.
- Se il tuo obiettivo principale è massimizzare il syngas: Passa dalla pirolisi alla gassificazione operando a temperature più elevate (>700°C) e introducendo un agente come vapore o aria per guidare le reazioni che producono gas.
Comprendere questi percorsi di reazione è la chiave per trasformare la biomassa grezza in prodotti preziosi e su misura.
Tabella riassuntiva:
| Stadio della reazione | Processo chiave | Prodotti primari |
|---|---|---|
| Stadio 1: Decomposizione primaria | Cracking termico di cellulosa, emicellulosa e lignina in un ambiente privo di ossigeno. | Carbone solido, Vapori primari (Catrame), Gas non condensabili (CO, CO₂, H₂) |
| Stadio 2: Reazioni secondarie | Il carbone e i vapori reagiscono ulteriormente (es. Acqua-Gas, Boudouard, Cracking). | Bio-carbone, Bio-olio e Syngas finali |
| Fattore di controllo | Condizioni di processo (Temperatura, Velocità di riscaldamento, Tempo di residenza) | Determina le rese finali dei prodotti |
Pronto a padroneggiare il tuo processo di pirolisi?
Comprendere le complesse reazioni è il primo passo; il controllo preciso è la chiave del successo. KINTEK è specializzata in attrezzature da laboratorio avanzate e materiali di consumo per la ricerca e l'analisi della biomassa.
Sia che tu stia sviluppando un processo per massimizzare il bio-carbone per l'amendamento del suolo, il bio-olio per combustibili rinnovabili o il syngas per l'energia, l'attrezzatura giusta garantisce un controllo accurato della temperatura e la gestione delle reazioni.
Lascia che l'esperienza di KINTEK supporti la missione del tuo laboratorio:
- Ottieni un controllo preciso: Ottimizza la temperatura e le velocità di riscaldamento per orientare le reazioni secondarie verso il prodotto desiderato.
- Migliora l'accuratezza della ricerca: Forni e reattori affidabili per risultati riproducibili negli studi di pirolisi.
- Scala le tue innovazioni: Dalla sperimentazione su scala di laboratorio allo sviluppo di processi.
Contattaci oggi stesso per discutere come le nostre soluzioni possono aiutarti a sbloccare il pieno potenziale della pirolisi della biomassa per la tua specifica applicazione.
#ModuloDiContatto per una consulenza personalizzata!
Guida Visiva
Prodotti correlati
- Fornace a Pirolisi per Biomassa Rotante Elettrica Piccola Fornace Rotante
- Impianto di pirolisi a forno rotante elettrico Macchina Calcinatore Piccolo Forno Rotante Forno Rotante
- Fornace a Pirolisi Continua Elettrica Rotante per Lavorazione Piccola Scala
- Fornace a Tubo Rotante a Lavoro Continuo Sottovuoto Fornace a Tubo Rotante
- Fornace Rotante Elettrica per la Rigenerazione del Carbone Attivo
Domande frequenti
- Quali minerali subiscono la calcinazione? Una guida alla lavorazione dei minerali carbonatici e idrati
- Qual è il tempo per la pirolisi veloce? Sblocca la massima resa di bio-olio in meno di 2 secondi
- Come possiamo convertire i rifiuti plastici in prodotti utili? Esplora il riciclo meccanico vs. chimico
- È possibile utilizzare la pirolisi sulla plastica? Sblocca il potenziale del riciclo chimico
- Qual è la temperatura della reazione di pirolisi rapida? Ottieni rese ottimali di bio-olio con un controllo termico preciso
- Come funziona la pirolisi senza ossigeno? Trasforma i rifiuti in prodotti di valore
- Quali sono i requisiti per la pirolisi? Controlla Temperatura e Atmosfera per il Prodotto Desiderato
- Quali sono i componenti della pirolisi della biomassa? Una guida completa al sistema, ai prodotti e al processo



















