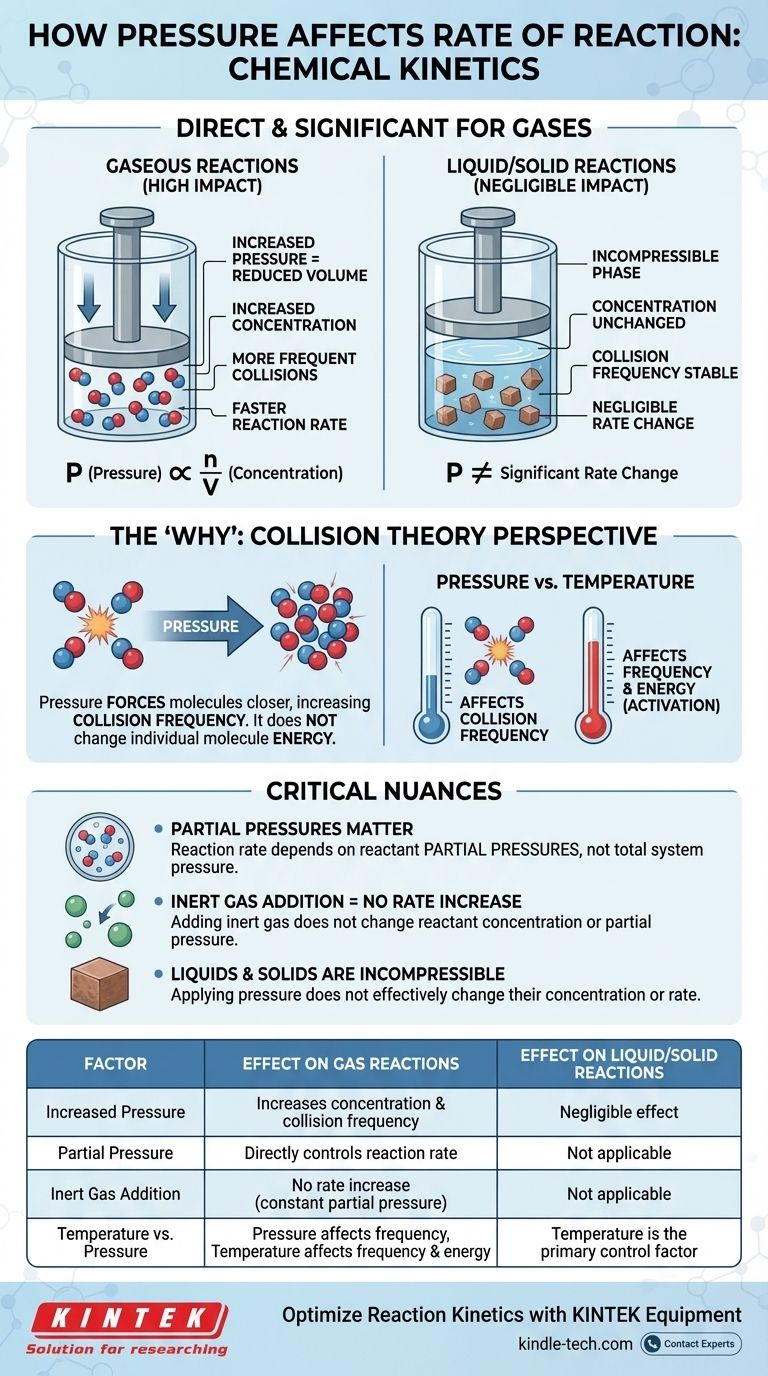
Nella cinetica chimica, l'effetto della pressione sulla velocità di reazione è diretto e significativo, ma solo per le reazioni che coinvolgono gas. Per una reazione gassosa, l'aumento della pressione aumenta la concentrazione delle molecole dei reagenti. Ciò porta a collisioni più frequenti tra di esse, il che a sua volta aumenta la velocità complessiva della reazione. Per le reazioni che avvengono puramente in fase liquida o solida, la pressione ha un effetto trascurabile sulla velocità.
La relazione tra pressione e velocità di reazione è fondamentalmente una storia sulla concentrazione. Per i gas, l'aumento della pressione è semplicemente un mezzo fisico per forzare più molecole nello stesso volume, aumentando la frequenza delle collisioni efficaci e quindi accelerando la reazione.

Il legame fondamentale: la pressione come indicatore della concentrazione
La ragione principale per cui la pressione influisce sulle reazioni gassose risiede nella sua relazione diretta con la concentrazione. Questo principio è spiegato al meglio osservando le leggi fondamentali della chimica.
Il ruolo della legge dei gas ideali
La legge dei gas ideali, PV = nRT, fornisce il collegamento matematico. Se la riorganizziamo per risolvere la pressione (P = (n/V)RT), possiamo vedere che la pressione (P) è direttamente proporzionale a n/V.
Il termine n/V rappresenta le moli (n) per unità di volume (V), che è la definizione stessa di concentrazione molare. Pertanto, quando si aumenta la pressione di un sistema a temperatura costante, si aumenta direttamente la concentrazione delle molecole di gas al suo interno.
Come la concentrazione governa la velocità di reazione
La velocità di una reazione è definita dalla sua legge di velocità, spesso espressa come rate = k[A]^m[B]^n. In questa equazione, [A] e [B] rappresentano le concentrazioni dei reagenti.
La legge di velocità mostra che la velocità di reazione dipende direttamente dalla concentrazione dei suoi reagenti. Una concentrazione più alta significa una velocità maggiore. Collegando questo alla legge dei gas, la catena di eventi diventa chiara: aumentare la pressione aumenta la concentrazione, che a sua volta aumenta la velocità di reazione.
Il "perché" del cambiamento: una prospettiva della teoria delle collisioni
Le leggi di velocità ci dicono cosa succede, ma la Teoria delle Collisioni spiega perché succede a livello molecolare. Affinché avvenga una reazione, le particelle reagenti devono collidere con energia sufficiente e con l'orientamento corretto.
Il principio della frequenza di collisione
Una reazione chimica è il risultato di innumerevoli collisioni molecolari. Più collisioni avvengono al secondo, più opportunità ci sono che si verifichi una reazione di successo.
Come la pressione aumenta le collisioni
L'aumento della pressione su un gas riduce il volume che occupa, costringendo le molecole ad avvicinarsi. Ciò aumenta drasticamente la loro frequenza di collisione: il numero di volte in cui si scontrano tra loro per unità di tempo.
Sebbene la pressione non modifichi l'energia delle singole molecole (questo è il ruolo della temperatura), moltiplica il numero totale di eventi di collisione. Questo aumento di frequenza porta a un aumento proporzionale delle collisioni riuscite che causano la reazione.
Comprendere le sfumature e i compromessi
Sebbene la regola generale sia valida, un esperto deve comprendere le condizioni specifiche in cui si applica e, soprattutto, quando non si applica.
Il ruolo critico delle pressioni parziali
In una miscela di gas, la velocità di reazione complessiva dipende dalle pressioni parziali dei reagenti specifici, non dalla pressione totale del sistema. La pressione parziale è la pressione che un singolo gas eserciterebbe se occupasse da solo l'intero volume.
Ciò significa che è possibile aumentare la pressione totale aggiungendo un gas inerte (come argon o azoto) al recipiente di reazione. Tuttavia, poiché ciò non modifica la concentrazione o la pressione parziale dei reagenti effettivi, non aumenterà la velocità di reazione.
L'effetto insignificante su liquidi e solidi
La pressione ha un impatto trascurabile sulla velocità di reazione nelle fasi condensate (liquidi e solidi). Questi stati della materia sono già considerati incomprimibili.
Le molecole nei liquidi e nei solidi sono già stipate strettamente insieme. L'applicazione di pressione esterna non riduce in modo significativo la distanza tra loro né ne modifica la concentrazione. Pertanto, non è una leva efficace per modificarne le velocità di reazione.
Pressione rispetto a temperatura
È fondamentale distinguere gli effetti della pressione e della temperatura.
- La pressione influisce principalmente sulla frequenza delle collisioni.
- La temperatura influisce sia sulla frequenza delle collisioni (le molecole si muovono più velocemente) sia, cosa più importante, sull'energia di ogni collisione.
L'aumento della temperatura aumenta la frazione di molecole che possiedono l'energia di attivazione minima richiesta, rendendola un fattore molto più potente per aumentare le velocità di reazione rispetto alla pressione.
Fare la scelta giusta per il tuo sistema
Comprendere questo principio ti consente di controllare i risultati della reazione in base ai tuoi obiettivi specifici. Considera quanto segue quando progetti o ottimizzi un processo chimico.
- Se il tuo obiettivo principale è massimizzare la velocità di una reazione gassosa: Aumentare la pressione del sistema riducendone il volume è un metodo diretto ed efficace per aumentare la produttività.
- Se il tuo obiettivo principale è controllare una reazione in una miscela di gas: Devi gestire le pressioni parziali dei reagenti, poiché la semplice aggiunta di un gas inerte per aumentare la pressione totale non accelererà la reazione target.
- Se il tuo obiettivo principale è alterare la velocità di una reazione in un liquido o solido: Manipolare la pressione non è una strategia praticabile; dovresti concentrarti sulla modifica della temperatura, della concentrazione delle specie disciolte o sull'uso di un catalizzatore.
Comprendendo che la pressione è un indicatore della concentrazione nei gas, si ottiene un controllo preciso sulla cinetica del proprio sistema.
Tabella riassuntiva:
| Fattore | Effetto sulle reazioni gassose | Effetto sulle reazioni liquido/solido |
|---|---|---|
| Aumento della pressione | Aumenta la concentrazione e la frequenza di collisione | Effetto trascurabile (incomprimibile) |
| Pressione parziale | Controlla direttamente la velocità di reazione | Non applicabile |
| Aggiunta di gas inerte | Nessun aumento di velocità (pressione parziale costante) | Non applicabile |
| Temperatura vs. Pressione | La pressione influisce sulla frequenza; la temperatura influisce su frequenza ed energia | La temperatura è il fattore di controllo principale |
Hai bisogno di controllare con precisione le tue reazioni chimiche? KINTEK è specializzata in attrezzature da laboratorio di alta qualità, inclusi reattori a pressione e sistemi di gestione dei gas, per aiutarti a ottimizzare la cinetica di reazione e ottenere risultati superiori nel tuo laboratorio. Contatta oggi i nostri esperti per discutere la tua applicazione specifica e scoprire la soluzione giusta per le tue esigenze.
Guida Visiva
Prodotti correlati
- Reattori personalizzabili ad alta pressione per applicazioni scientifiche e industriali avanzate
- Mini reattore autoclave ad alta pressione in SS per uso di laboratorio
- Reattore Autoclave di Laboratorio ad Alta Pressione in Acciaio Inossidabile
- Reattore Autoclave da Laboratorio ad Alta Pressione per Sintesi Idrotermale
- Macchina per pressa isostatica a freddo da laboratorio elettrica divisa per pressatura isostatica a freddo
Domande frequenti
- Qual è il contributo di un reattore idrotermale alla costruzione di pori graduati? Modelli di precisione per TAS
- Quale ruolo svolge un'autoclave nella simulazione delle condizioni PWR? Validazione avanzata dei materiali per la sicurezza nucleare
- Perché i recipienti di reazione sigillati da laboratorio sono necessari nella sintesi idrotermale delle zeoliti? Garantire purezza e resa
- Quali ruoli svolgono gli autoclavi nella sintesi delle zeoliti MFI? Padronanza della crescita cristallina idrotermale
- Perché gli autoclavi ad alta pressione sono essenziali per la preparazione di agenti indurenti a base di poliammide bio-based dall'acido dimerico?



















