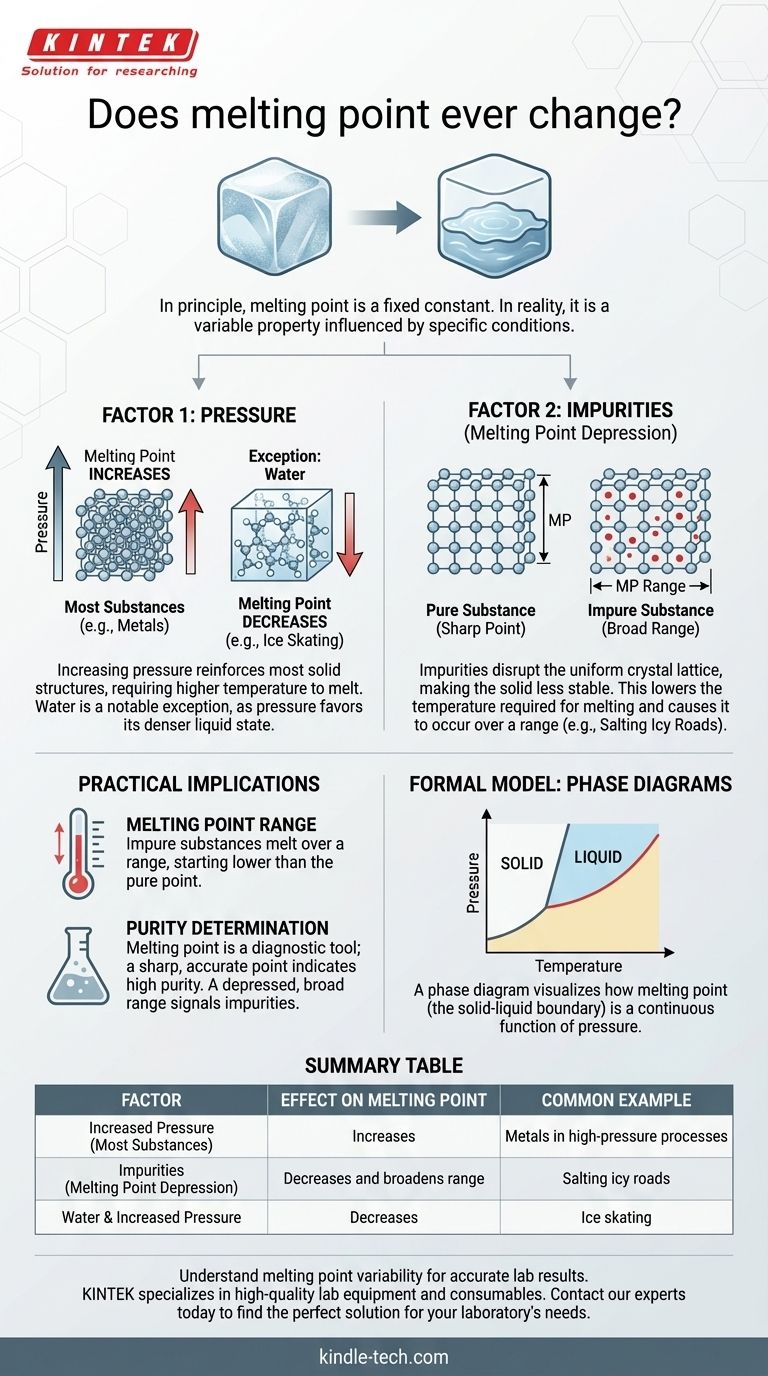
In linea di principio, il punto di fusione di una sostanza pura è una costante fisica fissa. Tuttavia, nel mondo reale, la temperatura osservata alla quale una sostanza fonde può assolutamente cambiare. Questo non è un cambiamento arbitrario; è una risposta prevedibile a due fattori primari: i cambiamenti nella pressione ambiente e l'introduzione di impurità nella sostanza.
Sebbene i libri di testo presentino spesso il punto di fusione come un numero statico, è più accuratamente inteso come una proprietà che è costante solo in un determinato insieme di condizioni. Comprendere come la pressione e la purezza influenzano questa proprietà è la chiave per prevedere e controllare il suo comportamento in qualsiasi applicazione nel mondo reale.

I due fattori che alterano il punto di fusione
Il punto di fusione "ufficiale" di una sostanza, come l'acqua a 0°C (32°F), viene misurato in condizioni standard—tipicamente a un'atmosfera di pressione e con la sostanza in uno stato altamente puro. Quando queste condizioni non sono soddisfatte, il punto di fusione devierà.
Fattore 1: L'influenza della pressione
Per la maggior parte delle sostanze, l'aumento della pressione esterna costringe le molecole a un arrangiamento più compatto. Questo rafforza la struttura solida, richiedendo più energia (una temperatura più alta) per rompere i legami e passare allo stato liquido.
Pertanto, per la stragrande maggioranza dei materiali, un aumento della pressione porta a un aumento del punto di fusione.
Esiste, tuttavia, un'eccezione critica e famosa: l'acqua. L'acqua solida (ghiaccio) è meno densa dell'acqua liquida, motivo per cui gli iceberg galleggiano. L'aumento della pressione sul ghiaccio favorisce lo stato più denso—l'acqua liquida. Ciò significa che sotto una pressione più elevata, il ghiaccio fonde a una temperatura inferiore. Questo è il motivo per cui la lama di un pattino da ghiaccio, esercitando alta pressione su una linea sottile, può creare uno strato microscopico d'acqua su cui scivolare.
Fattore 2: Il ruolo delle impurità
Questa è la ragione più comune per un cambiamento nel punto di fusione al di fuori di un laboratorio ad alta pressione. Quando si introduce un'impurità (un soluto) in una sostanza pura (un solvente), essa interrompe il reticolo cristallino uniforme e ripetitivo del solido.
Questa interruzione rende la struttura solida meno stabile. Di conseguenza, è necessaria meno energia per romperla e trasformarla in liquido. Questo fenomeno è noto come abbassamento crioscopico.
Un esempio classico è la salatura delle strade ghiacciate. Il sale si mescola con il ghiaccio, abbassandone il punto di fusione. Ciò consente al ghiaccio di sciogliersi anche quando la temperatura dell'aria ambiente è ancora al di sotto del normale punto di congelamento dell'acqua.
Comprendere le implicazioni pratiche
Riconoscere che il punto di fusione può cambiare non è solo un esercizio accademico. Ha conseguenze significative in contesti scientifici e industriali, dove viene spesso utilizzato come strumento diagnostico.
Da un "punto" a un "intervallo"
Un solido cristallino puro tipicamente fonde a una temperatura molto precisa e specifica. Quando si inizia a riscaldarlo, la temperatura aumenta fino a raggiungere il punto di fusione, dove rimane costante finché tutto il solido non si è trasformato in liquido.
Una sostanza impura si comporta in modo diverso. Non fonde a una singola temperatura ma in un intervallo di fusione. La fusione inizia a una temperatura inferiore rispetto alla sostanza pura e si completa a una temperatura più vicina, ma spesso ancora inferiore, al punto di fusione della sostanza pura.
Utilizzo del punto di fusione per determinare la purezza
Questo "difetto" è in realtà una caratteristica incredibilmente utile. In un laboratorio di chimica, uno dei primi e più rapidi modi per valutare la purezza di un composto cristallino sintetizzato è misurarne il punto di fusione.
Se il composto fonde in un ampio intervallo e a una temperatura inferiore al valore di letteratura, è un chiaro segno che sono presenti impurità e che è necessaria un'ulteriore purificazione. Un punto di fusione netto che corrisponde al valore stabilito è un forte indicatore di elevata purezza.
Il modello formale: diagrammi di fase
La relazione tra pressione, temperatura e stato di una sostanza (solido, liquido, gas) è formalmente catturata in un diagramma di fase.
Una mappa degli stati fisici
Un diagramma di fase è un grafico con la pressione sull'asse y e la temperatura sull'asse x. Le linee sul grafico delineano i confini in cui la sostanza transita tra le diverse fasi.
Il confine solido-liquido
La linea che separa la fase solida dalla fase liquida su questo diagramma rappresenta il punto di fusione a ogni possibile pressione. Osservando questo grafico diventa immediatamente chiaro che il punto di fusione non è un singolo numero ma una funzione continua della pressione. Questo modello visivo unifica i concetti e dimostra che il punto di fusione è intrinsecamente variabile.
Scegliere la soluzione giusta per il tuo obiettivo
La tua prospettiva sul punto di fusione dovrebbe essere dettata dal tuo obiettivo.
- Se il tuo obiettivo principale è la sintesi o l'analisi chimica: Tratta il punto di fusione come uno strumento diagnostico cruciale per la purezza. Un punto di fusione netto e accurato conferma il successo, mentre un intervallo ampio e abbassato segnala la necessità di purificazione.
- Se il tuo obiettivo principale è la scienza o l'ingegneria dei materiali: Devi tenere conto delle variazioni di pressione nei tuoi progetti. Il punto di fusione di un materiale a livello del mare potrebbe non essere lo stesso in un processo industriale ad alta pressione o in un'applicazione in profondità.
- Se il tuo obiettivo principale è comprendere i fenomeni quotidiani: Usa il principio dell'abbassamento crioscopico per spiegare perché saliamo le strade in inverno o perché aggiungere sale a un bagno di acqua e ghiaccio lo rende più freddo per la preparazione del gelato.
In definitiva, riconoscere che il punto di fusione è una proprietà dinamica, non un numero statico, lo trasforma da un semplice fatto in un potente strumento predittivo.
Tabella riassuntiva:
| Fattore | Effetto sul punto di fusione | Esempio comune |
|---|---|---|
| Pressione aumentata | Aumenta (per la maggior parte delle sostanze) | Metalli in processi ad alta pressione |
| Impurità (abbassamento crioscopico) | Diminuisce e allarga l'intervallo | Salatura delle strade ghiacciate |
| Acqua e pressione aumentata | Diminuisce | Pattinaggio su ghiaccio |
Hai bisogno di un controllo preciso della temperatura per il tuo lavoro di laboratorio?
Comprendere la variabilità del punto di fusione è fondamentale per una sintesi e un'analisi accurate. KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio di alta qualità, inclusi apparecchi per la determinazione del punto di fusione, progettati per offrire l'affidabilità e la precisione che il tuo laboratorio richiede.
Lasciaci aiutarti a ottenere risultati coerenti e accurati. Contatta i nostri esperti oggi per trovare la soluzione perfetta per le esigenze del tuo laboratorio.
Guida Visiva
Prodotti correlati
- Fornace a muffola con sollevamento inferiore per laboratorio
- Fornace a muffola da 1800℃ per laboratorio
- Fornace a muffola da 1400℃ per laboratorio
- Fornace a muffola da 1700℃ per laboratorio
- Fornace a tubo da laboratorio ad alta temperatura da 1400℃ con tubo in allumina
Domande frequenti
- Cosa si usa comunemente durante un esperimento di calcinazione a secco? Attrezzatura essenziale per un'analisi accurata delle ceneri
- Qual è uno svantaggio dell'incenerimento a secco? Evita risultati inaccurati con alternative migliori
- Quali sono le applicazioni dei forni a muffola? Strumenti essenziali per processi ad alta temperatura
- Qual è la temperatura di una fornace a muffola per la determinazione delle ceneri? Approfondimenti chiave per risultati accurati
- Quali sono le precauzioni di sicurezza per l'uso di un forno a muffola? Consigli essenziali per un funzionamento sicuro



















