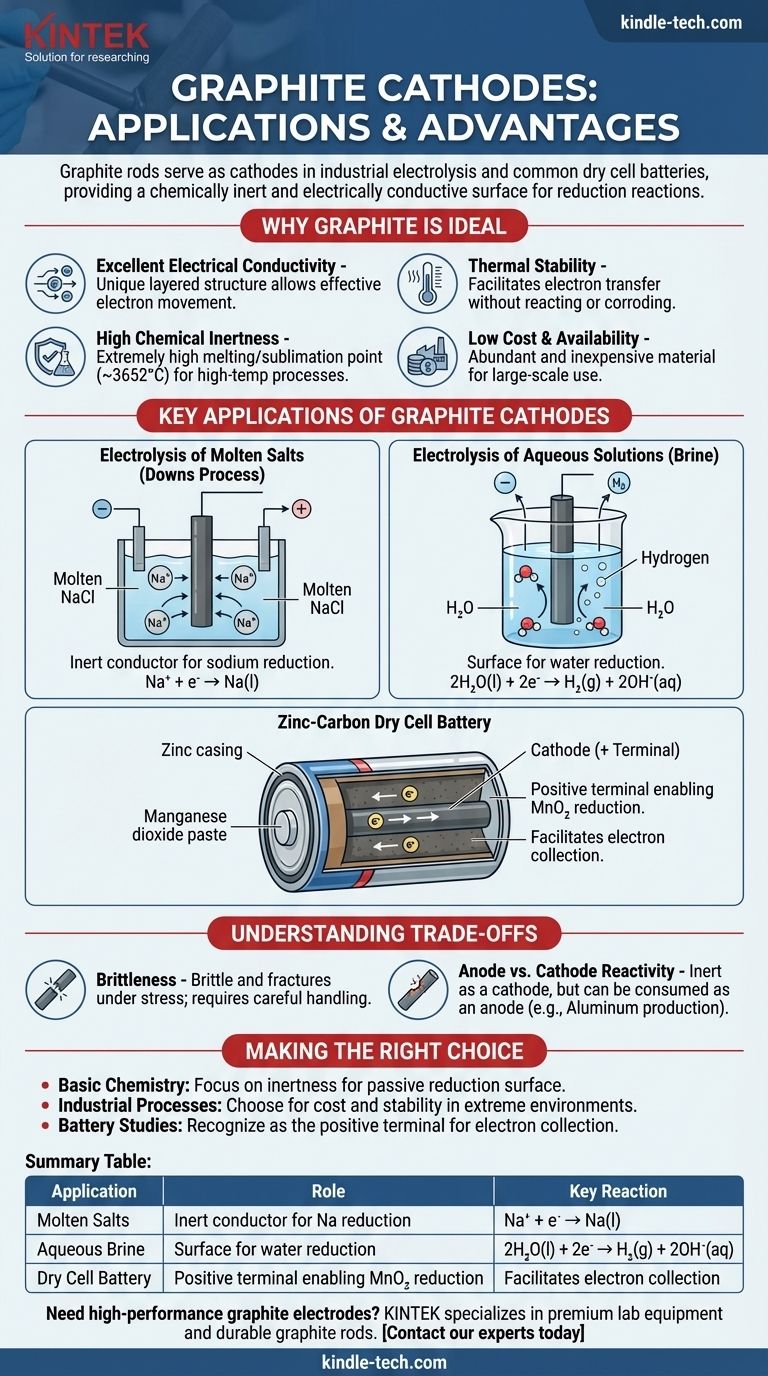
Le aste di grafite fungono da catodi in diversi processi elettrochimici chiave, in particolare nell'elettrolisi industriale dei sali e all'interno delle comuni pile a secco. In queste applicazioni, la funzione principale dell'asta di grafite non è quella di essere consumata o reagire, ma di agire come una superficie chimicamente inerte ed elettricamente conduttiva dove può avvenire una reazione di riduzione.
La grafite viene scelta come materiale catodico non perché partecipi alla reazione principale, ma perché è un eccellente conduttore inerte. La sua combinazione unica di conducibilità elettrica, resistenza chimica, elevata stabilità termica e basso costo la rende una piattaforma ideale per l'avvenimento della semireazione di riduzione.

Perché la grafite è un materiale catodico ideale
La scelta di un materiale per un elettrodo è una decisione progettuale critica in qualsiasi cella elettrochimica. La grafite (una forma specifica di carbonio) possiede una serie di proprietà che la rendono eccezionalmente adatta al ruolo di catodo.
Eccellente conducibilità elettrica
La grafite ha una struttura planare unica a strati. All'interno di questi strati, gli elettroni delocalizzati sono liberi di muoversi, consentendo alla grafite di condurre elettricità in modo molto efficace, un requisito necessario per qualsiasi elettrodo.
Elevata inerzia chimica
Come catodo, l'elettrodo deve facilitare il trasferimento di elettroni a una sostanza nell'elettrolita senza reagire esso stesso. Il carbonio è relativamente poco reattivo, soprattutto rispetto alla maggior parte dei metalli, il che significa che non si corroderà né interferirà con il processo chimico desiderato.
Stabilità termica
La grafite ha uno dei punti di fusione/sublimazione più alti di tutti gli elementi (circa 3652°C o 6606°F). Ciò la rende perfetta per processi elettrochimici ad alta temperatura, come l'elettrolisi di sali fusi, dove gli elettrodi metallici si scioglierebbero.
Basso costo e disponibilità
Da una prospettiva industriale, la grafite è un materiale abbondante ed economico. Ciò rende economicamente fattibile la produzione elettrochimica su larga scala, che richiede elettrodi di grandi dimensioni.
Applicazioni chiave dei catodi in grafite
Comprendere gli specifici casi d'uso chiarisce la teoria. In ogni esempio, il catodo di grafite è semplicemente il luogo in cui vengono forniti gli elettroni per provocare un cambiamento chimico.
Elettrolisi di Sali Fusi (Processo Downs)
Nella produzione di sodio metallico puro da cloruro di sodio (NaCl) fuso, un'asta di grafite viene spesso utilizzata come catodo. Gli ioni sodio caricati positivamente (Na⁺) sono attratti dal catodo carico negativamente, dove acquisiscono un elettrone e vengono ridotti a sodio metallico liquido.
Na⁺ + e⁻ → Na(l)
Il catodo di grafite fornisce semplicemente la superficie e gli elettroni per questa reazione.
Elettrolisi di Soluzioni Acquose (Salamoia)
Quando si elettrolizza una soluzione acquosa di cloruro di sodio (salamoia), il catodo di grafite svolge un ruolo simile. Tuttavia, in questo caso, l'acqua è più facile da ridurre rispetto agli ioni sodio.
Pertanto, le molecole d'acqua vengono ridotte sulla superficie del catodo di grafite, producendo idrogeno gassoso e ioni idrossido.
2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻(aq)
La Pila a Secco Zinco-Carbone
In una comune pila "heavy-duty", l'asta centrale è realizzata in grafite e funge da catodo (il terminale positivo). È circondata da una pasta umida di biossido di manganese (MnO₂) e altri prodotti chimici.
L'asta di grafite raccoglie gli elettroni dal circuito esterno. La reazione di riduzione avviene nella pasta adiacente all'asta, dove il biossido di manganese viene ridotto. La grafite facilita semplicemente questo processo.
Comprendere i compromessi
Sebbene sia molto efficace, la grafite non è un materiale perfetto. Riconoscere i suoi limiti è fondamentale per comprenderne le applicazioni.
Fragilità
A differenza dei metalli, che sono duttili, la grafite è fragile e può fratturarsi sotto shock o stress meccanico. Ciò richiede una manipolazione e un supporto attenti nei progetti industriali.
Reattività Anodo vs Catodo
Mentre la grafite è molto inerte come catodo, può essere consumata quando utilizzata come anodo (il sito di ossidazione) in alcuni processi. Ad esempio, nella produzione di alluminio, l'anodo di carbonio reagisce con l'ossigeno prodotto per formare gas CO₂ e viene lentamente consumato.
Confusione tra tipi di celle
Un punto comune di confusione è la polarità dell'elettrodo. Il catodo è sempre il sito di riduzione, ma il suo segno cambia a seconda del tipo di cella.
- In una cella elettrolitica (come per l'elettrolisi del sale), il catodo è il terminale negativo.
- In una cella galvanica (come una batteria), il catodo è il terminale positivo.
Fare la scelta giusta per il tuo obiettivo
Il motivo per cui chiedi dei catodi di grafite determina su quale aspetto è più importante concentrarsi.
- Se il tuo obiettivo principale è la chimica di base: Ricorda che la grafite è un conduttore inerte, che fornisce una superficie passiva affinché avvenga una reazione di riduzione senza reagire essa stessa.
- Se il tuo obiettivo principale sono i processi industriali: Scegli la grafite per la sua convenienza e stabilità senza pari in ambienti ad alta temperatura o corrosivi dove la maggior parte dei metalli fallirebbe.
- Se il tuo obiettivo principale è lo studio delle batterie: Riconosci che l'asta di grafite in una cella zinco-carbone funge da terminale positivo (catodo), fungendo da collettore di elettroni che consente la riduzione della pasta chimica circostante.
In definitiva, comprendere il ruolo della grafite come catodo significa riconoscere la potenza di un materiale inerte e conduttivo che abilita la chimica senza interferire con essa.
Tabella riassuntiva:
| Applicazione | Ruolo del Catodo in Grafite | Reazione Chiave |
|---|---|---|
| Elettrolisi di Sali Fusi (Processo Downs) | Conduttore inerte per la riduzione del sodio | Na⁺ + e⁻ → Na(l) |
| Elettrolisi della Salamoia Acquosa | Superficie per la riduzione dell'acqua | 2H₂O(l) + 2e⁻ → H₂(g) + 2OH⁻(aq) |
| Pila a Secco Zinco-Carbone | Terminale positivo che consente la riduzione di MnO₂ | Facilita la raccolta degli elettroni |
Hai bisogno di elettrodi in grafite ad alte prestazioni per i tuoi processi elettrochimici? KINTEK è specializzata in attrezzature e materiali di consumo di laboratorio di alta qualità, incluse aste di grafite durevoli progettate per una conducibilità e una stabilità termica superiori. Che tu stia eseguendo elettrolisi industriale o sviluppando tecnologie per batterie, i nostri materiali garantiscono prestazioni inerti e affidabili. Contatta oggi i nostri esperti per trovare la soluzione in grafite perfetta per le tue esigenze di laboratorio!
Guida Visiva
Prodotti correlati
- Lastra di grafite di carbonio prodotta con metodo di pressatura isostatica
- Materiale per lucidatura elettrodi per esperimenti elettrochimici
- Fornace di Grafittizzazione per Film ad Alta Conducibilità Termica al Vuoto di Grafite
- Fornace di grafitazione sottovuoto verticale ad alta temperatura
- Fornace di grafitazione sottovuoto verticale di grandi dimensioni
Domande frequenti
- Quali sono i vantaggi della biomassa? Sbloccare energia rinnovabile da rifiuti e colture
- Che ruolo gioca la convezione nel trasferimento di calore? Comprendere il movimento del calore nei fluidi
- Come possono materiali diversi avere capacità termiche diverse? Svelare i segreti microscopici dell'accumulo di energia
- Qual è la funzione del materiale di grafite nella preparazione dei corpi sinterizzati di Ga-LLZO? Garantire l'integrità del campione in HIP
- La grafite conduce l'elettricità? Svelare i segreti della sua struttura atomica



















