No, la grafite non è un metallo, ma è un eccellente conduttore elettrico. Questa distinzione è fonte di frequente confusione, poiché siamo spesso abituati ad associare la conducibilità esclusivamente agli elementi metallici. La grafite è un allotropo — una forma strutturale specifica — dell'elemento non metallico carbonio.
La ragione principale di questa confusione è che tendiamo a raggruppare i materiali in categorie semplici piuttosto che in base alla loro struttura fondamentale. La grafite, pur essendo un non-metallo, conduce elettricità perché la sua unica disposizione atomica a strati crea elettroni "liberi" che si comportano quasi esattamente come gli elettroni in un vero metallo.

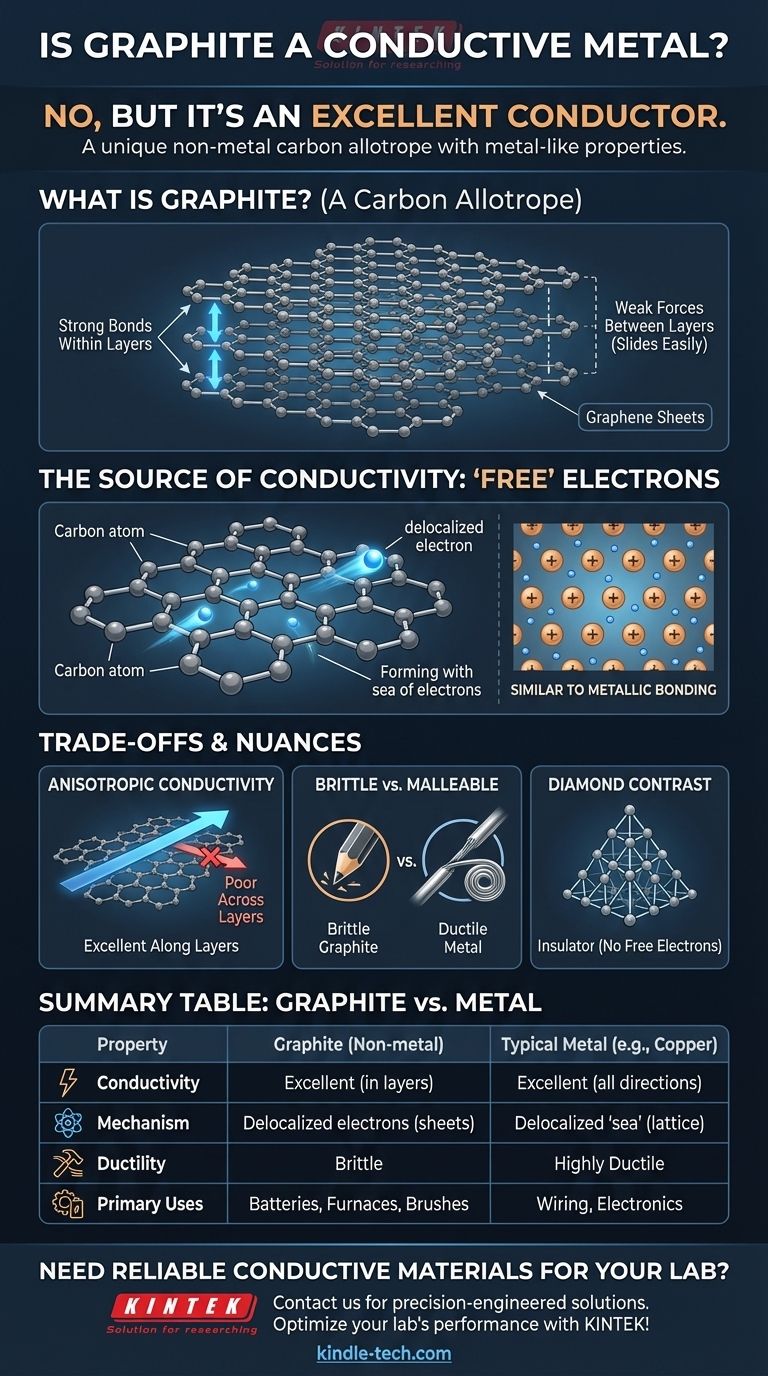
Cos'è la Grafite? Una Forma Unica di Carbonio
Le proprietà della grafite derivano direttamente dalla sua struttura atomica unica. Comprendere questa struttura è fondamentale per capirne il comportamento.
Non un Metallo, ma un Allotropo
Gli elementi possono esistere in diverse forme fisiche chiamate allotropi. Queste forme hanno gli stessi atomi ma disposizioni strutturali diverse, il che conferisce loro proprietà molto diverse.
La grafite è un allotropo del carbonio. L'altro allotropo di carbonio più famoso è il diamante. Sebbene entrambi siano carbonio puro, le loro strutture rendono la grafite un conduttore morbido e il diamante un isolante duro.
Una Struttura di Strati Impilati
La grafite è composta da innumerevoli fogli piatti impilati l'uno sull'altro. Ogni foglio, noto come grafene, è uno strato spesso un atomo di atomi di carbonio disposti in un reticolo esagonale simile a un nido d'ape.
I legami che tengono insieme gli atomi all'interno di un foglio sono incredibilmente forti. Tuttavia, le forze che tengono insieme i diversi fogli l'uno all'altro sono molto deboli, permettendo loro di scivolare facilmente via. Questo è il motivo per cui la grafite è morbida e sfaldabile, formando la "mina" nelle matite.
La Fonte della Conducibilità della Grafite
Il motivo per cui la grafite conduce elettricità risiede nel modo in cui i suoi elettroni sono condivisi — o meglio, non condivisi. Questo imita il meccanismo conduttivo dei metalli senza che la grafite sia essa stessa un metallo.
Il Ruolo degli Elettroni del Carbonio
Ogni atomo di carbonio ha quattro elettroni esterni (elettroni di valenza) disponibili per il legame. Nella struttura esagonale di un foglio di grafene, ogni atomo di carbonio forma forti legami covalenti con tre atomi vicini.
L'Elettrone "Libero" Delocalizzato
Questo lascia un elettrone di valenza su quattro non contabilizzato. Questo quarto elettrone non è bloccato in un legame tra due atomi specifici. Invece, diventa delocalizzato, libero di muoversi ovunque lungo il suo foglio di grafene bidimensionale.
Un "Mare di Elettroni" in un Non-Metallo
Questa raccolta di elettroni delocalizzati forma un "mare di elettroni" mobile all'interno di ogni strato. Poiché una corrente elettrica è semplicemente il flusso di elettroni, questi elettroni in movimento libero consentono alla grafite di condurre elettricità con facilità.
Questo è fondamentalmente simile al legame metallico, in cui un reticolo di ioni metallici positivi si trova in un "mare" di elettroni condivisi e delocalizzati. La grafite ottiene un risultato simile utilizzando una struttura atomica completamente diversa.
Comprendere i Compromessi e le Sfumature
Sebbene la grafite sia un conduttore, non è un sostituto perfetto per i metalli. La sua natura non metallica comporta compromessi distinti.
La Conducibilità Non è Uniforme
La grafite è altamente anisotropa, il che significa che le sue proprietà dipendono dalla direzione. Conduce elettricità estremamente bene lungo i suoi fogli di grafene, ma molto male attraverso di essi. La maggior parte dei metalli, al contrario, è isotropa e conduce elettricità con la stessa efficacia in tutte le direzioni.
Fragilità vs. Duttilità
I metalli sono tipicamente duttili e malleabili, il che significa che possono essere tirati in fili o martellati in nuove forme senza rompersi. La grafite è fragile e si frantuma sotto uno stress simile. Non è possibile formare un filo di grafite tirandolo.
Diamante: La Controparte Isolante
Il diamante fornisce il contrasto perfetto. Nel suo reticolo tetraedrico rigido, ogni atomo di carbonio si lega ad altri quattro, utilizzando tutti e quattro gli elettroni di valenza. Senza elettroni delocalizzati, non c'è nulla di libero di muoversi e trasportare una corrente, rendendo il diamante un eccellente isolante elettrico.
Fare la Scelta Giusta per la Tua Applicazione
Comprendere questi principi ti permette di selezionare il materiale giusto in base alle proprietà specifiche richieste per un compito.
- Se la tua attenzione principale è sulla conducibilità flessibile e omnidirezionale: I metalli come il rame e l'alluminio rimangono la scelta superiore grazie alla loro duttilità e natura isotropa.
- Se la tua attenzione principale è un conduttore leggero e chimicamente stabile per alte temperature: La grafite è un materiale ideale per applicazioni come elettrodi di batterie, rivestimenti per forni e spazzole per motori elettrici.
- Se la tua attenzione principale è la durezza e l'isolamento elettrico: Il diamante, l'altro famoso allotropo del carbonio, è la soluzione, dimostrando che la disposizione atomica determina tutto.
In definitiva, le proprietà di un materiale sono definite dalla sua struttura atomica, non dalla semplice categoria in cui lo collochiamo.
Tabella Riassuntiva:
| Proprietà | Grafite | Metallo Tipico (es. Rame) |
|---|---|---|
| Tipo di Materiale | Non-metallo (Allotropo del Carbonio) | Metallo |
| Conducibilità Elettrica | Eccellente (all'interno degli strati) | Eccellente (in tutte le direzioni) |
| Meccanismo di Conduzione | Elettroni delocalizzati nei fogli di grafene | "Mare di elettroni" delocalizzati |
| Duttilità/Malleabilità | Fragile, non può essere tirata in fili | Altamente duttile e malleabile |
| Principali Casi d'Uso | Batterie, rivestimenti per forni, spazzole per motori | Cablaggio, componenti strutturali, elettronica |
Hai bisogno di un materiale conduttivo affidabile per la tua applicazione di laboratorio? Che tu stia lavorando con forni ad alta temperatura, ricerca sulle batterie o configurazioni di elettrodi personalizzate, l'esperienza di KINTEK nelle apparecchiature e nei materiali di consumo da laboratorio ti assicura di ottenere la soluzione giusta. Il nostro team può aiutarti a selezionare materiali che soddisfino i tuoi specifici requisiti di conducibilità, temperatura e durata. Contattaci oggi per ottimizzare le prestazioni del tuo laboratorio con soluzioni ingegnerizzate con precisione da KINTEK!
Guida Visiva
Prodotti correlati
- Elettrodo Elettrochimico in Grafite, Elettrodo a Disco e Asta in Grafite
- Lastra di grafite di carbonio prodotta con metodo di pressatura isostatica
- Fornace di grafitazione sottovuoto verticale ad alta temperatura
- Fornace di grafitazione sottovuoto verticale di grandi dimensioni
- Fornace di Grafittizzazione Continua Sottovuoto di Grafite
Domande frequenti
- Qual è la funzione principale degli elettrodi di grafite ad alta purezza nella lisciviazione AC? Alimentare un recupero efficiente dei metalli
- Perché un'asta di grafite ad alta purezza viene selezionata come elettrodo di controbilanciamento per l'EIS? Garantire l'integrità dei dati e la stabilità chimica
- Quali vantaggi tecnici offrono gli elettrodi in grafite di carbonio per i biofilm elettroattivi? Ottimizza la tua bio-ricerca
- Perché un'asta di grafite ad alta purezza è preferita come controelettrodo? Garantire un'analisi elettrochimica non contaminata
- Quali sono le caratteristiche e le applicazioni di un elettrodo a lamina di grafite? Massimizzare l'area di reazione per l'elettrolisi di massa



















