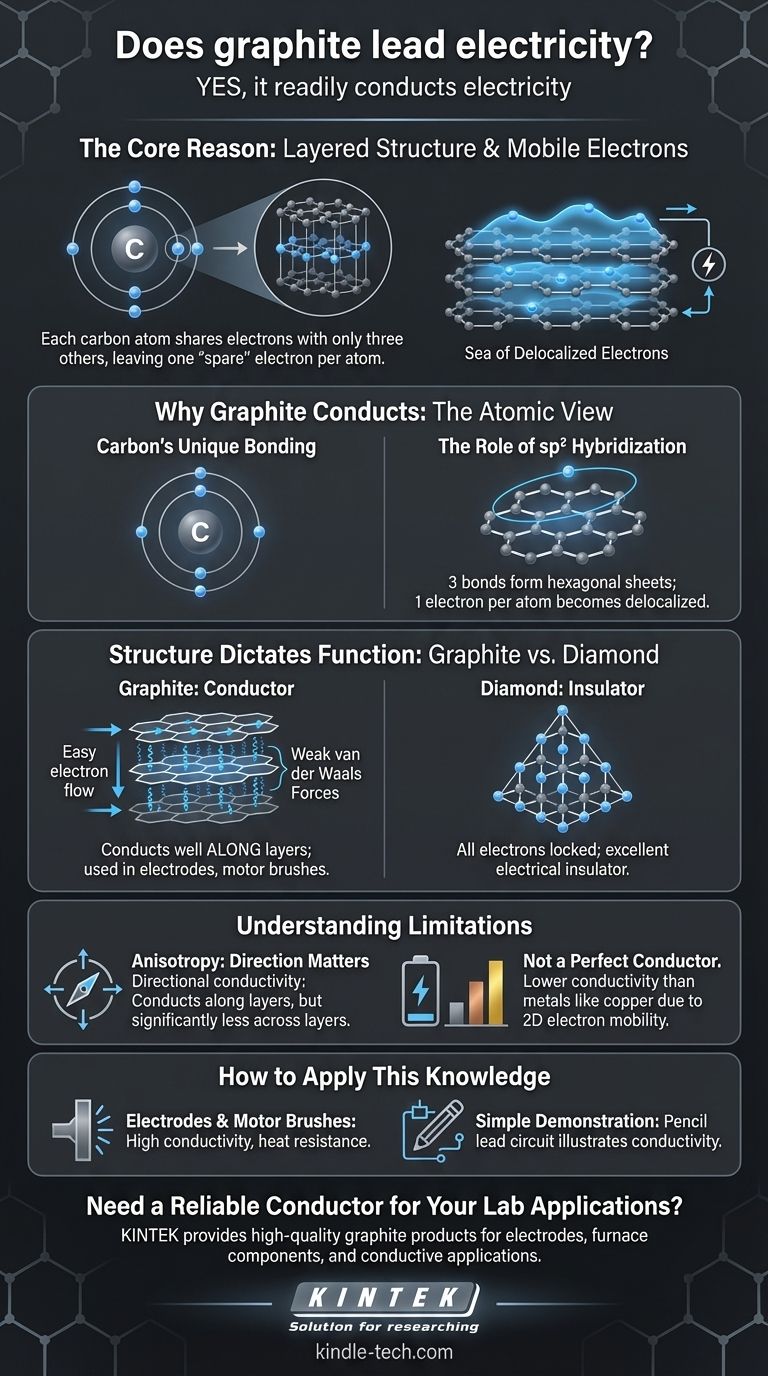
Sì, la grafite conduce facilmente l'elettricità. È uno dei pochi non-metalli che è un efficace conduttore elettrico, una proprietà che deriva direttamente dalla sua unica struttura atomica e dal comportamento dei suoi elettroni.
La ragione principale per cui la grafite conduce l'elettricità è la sua struttura a strati. Ogni atomo di carbonio condivide elettroni con solo altri tre atomi, lasciando un elettrone per atomo libero di muoversi lungo questi strati, creando un "mare" di elettroni mobili che possono trasportare una corrente elettrica.

Perché la grafite conduce l'elettricità: la visione atomica
Per comprendere la conduttività della grafite, dobbiamo esaminare come i suoi atomi di carbonio sono disposti e legati. La spiegazione risiede in un concetto chiamato delocalizzazione degli elettroni.
Il legame unico del carbonio
Un atomo di carbonio ha quattro elettroni nel guscio esterno (elettroni di valenza) disponibili per il legame. In molti composti del carbonio, come il metano o il diamante, tutti e quattro questi elettroni formano legami forti e localizzati.
Il ruolo dell'ibridazione sp2
Nella grafite, tuttavia, ogni atomo di carbonio utilizza solo tre dei suoi quattro elettroni di valenza per formare forti legami covalenti con tre atomi vicini. Questa disposizione, nota come ibridazione sp2, crea un reticolo esagonale piatto, molto simile a una rete metallica.
Un "mare" di elettroni delocalizzati
Questo lascia un elettrone per atomo di carbonio non legato. Questi elettroni "di riserva" non sono bloccati tra due atomi specifici; invece, diventano delocalizzati, formando una nuvola di elettroni in movimento libero attraverso l'intero piano del foglio esagonale. Quando viene applicata una tensione, questi elettroni mobili fluiscono, creando una corrente elettrica.
La struttura detta la funzione: grafite vs. diamante
Il contrasto tra grafite e diamante, entrambe forme pure di carbonio, fornisce l'illustrazione più chiara di come la struttura atomica determini le proprietà elettriche.
Il reticolo a strati della grafite
La grafite è essenzialmente costituita da fogli impilati di questi strati esagonali di carbonio (ora noti come grafene). Gli elettroni delocalizzati si muovono con facilità lungo questi strati, rendendo la grafite altamente conduttiva in quella direzione.
Gli strati stessi sono tenuti insieme da forze molto più deboli (forze di van der Waals), motivo per cui la grafite è scivolosa e viene usata come lubrificante.
La fortezza rigida del diamante
In un diamante, ogni atomo di carbonio utilizza tutti e quattro i suoi elettroni di valenza per legarsi con altri quattro atomi di carbonio in un reticolo tetraedrico rigido e tridimensionale. Questo è noto come ibridazione sp3.
Poiché tutti gli elettroni sono bloccati in legami covalenti forti e localizzati, non ci sono elettroni mobili per trasportare una corrente. Questo rende il diamante un eccellente isolante elettrico.
Comprendere i limiti
Sebbene la grafite sia un conduttore, le sue proprietà non sono uniformi e non si comporta esattamente come un tipico metallo.
Anisotropia: la direzione conta
La grafite è un conduttore anisotropo. Ciò significa che la sua conduttività è direzionale. Conduce l'elettricità estremamente bene lungo i suoi strati ma è significativamente meno conduttiva attraverso gli strati. I legami deboli tra gli strati agiscono come una barriera al flusso di elettroni.
Non un conduttore perfetto
Sebbene sia un buon conduttore per un non-metallo, la sua conduttività è generalmente inferiore a quella di metalli come rame, argento o oro. Questo perché i metalli hanno un mare tridimensionale di elettroni, mentre la mobilità degli elettroni della grafite è principalmente bidimensionale.
Come applicare questa conoscenza
La comprensione delle proprietà della grafite ne consente l'uso in un'ampia gamma di applicazioni, dalle matite di uso quotidiano all'elettronica ad alta tecnologia.
- Se il tuo obiettivo principale è creare elettrodi o spazzole per motori: la combinazione di alta conduttività, resistenza al calore e proprietà autolubrificanti della grafite la rende una scelta ideale.
- Se il tuo obiettivo principale è nei materiali avanzati: riconosci che un singolo strato di grafite è il grafene, un materiale con straordinarie proprietà elettriche e meccaniche su scala nanometrica.
- Se il tuo obiettivo principale è una semplice dimostrazione di conduttività: una comune "mina" di matita (che è una miscela di grafite e argilla) può essere utilizzata per disegnare un circuito conduttivo su carta, illustrando il principio in modo sicuro e accessibile.
In definitiva, la grafite è un esempio perfetto di come la disposizione atomica di un materiale ne detti la funzione nel mondo reale.
Tabella riassuntiva:
| Proprietà | Grafite | Diamante |
|---|---|---|
| Conduttività elettrica | Buon conduttore (lungo gli strati) | Eccellente isolante |
| Legame atomico | Ibridazione sp2 (3 legami) | Ibridazione sp3 (4 legami) |
| Comportamento degli elettroni | Elettroni delocalizzati si muovono lungo gli strati | Tutti gli elettroni sono bloccati nei legami |
| Struttura | Fogli esagonali a strati | Reticolo tetraedrico 3D rigido |
Hai bisogno di un conduttore affidabile per le tue applicazioni di laboratorio?
Le proprietà uniche della grafite la rendono un materiale essenziale per elettrodi, componenti di forni e altre applicazioni conduttive ad alta temperatura.
Presso KINTEK, siamo specializzati nella fornitura di attrezzature e materiali di consumo da laboratorio di alta qualità, inclusi prodotti in grafite su misura per soddisfare le rigorose esigenze del tuo laboratorio. La nostra esperienza ti garantisce di ottenere i materiali giusti per un controllo preciso della temperatura, un riscaldamento uniforme e prestazioni durature.
Migliora l'efficienza e l'affidabilità del tuo laboratorio—contatta i nostri esperti oggi stesso per trovare la soluzione perfetta per le tue esigenze!
Guida Visiva
Prodotti correlati
- Lastra di grafite di carbonio prodotta con metodo di pressatura isostatica
- Fornace di grafitazione sottovuoto verticale ad alta temperatura
- Barca in grafite di carbonio - Forno a tubo da laboratorio con coperchio
- Fornace di grafitazione sottovuoto verticale di grandi dimensioni
- Fornace di Grafittizzazione Continua Sottovuoto di Grafite
Domande frequenti
- Quali sono i tre tipi di rivestimento? Una guida ai rivestimenti architettonici, industriali e per scopi speciali
- Qual è la funzione del materiale di grafite nella preparazione dei corpi sinterizzati di Ga-LLZO? Garantire l'integrità del campione in HIP
- Quali sono le proprietà della grafite? Sblocca resistenza ad alta temperatura e conduttività
- Che ruolo gioca la convezione nel trasferimento di calore? Comprendere il movimento del calore nei fluidi
- Qual è lo scopo della laminazione? Proteggi e Migliora i Tuoi Documenti per un Uso a Lungo Termine



















