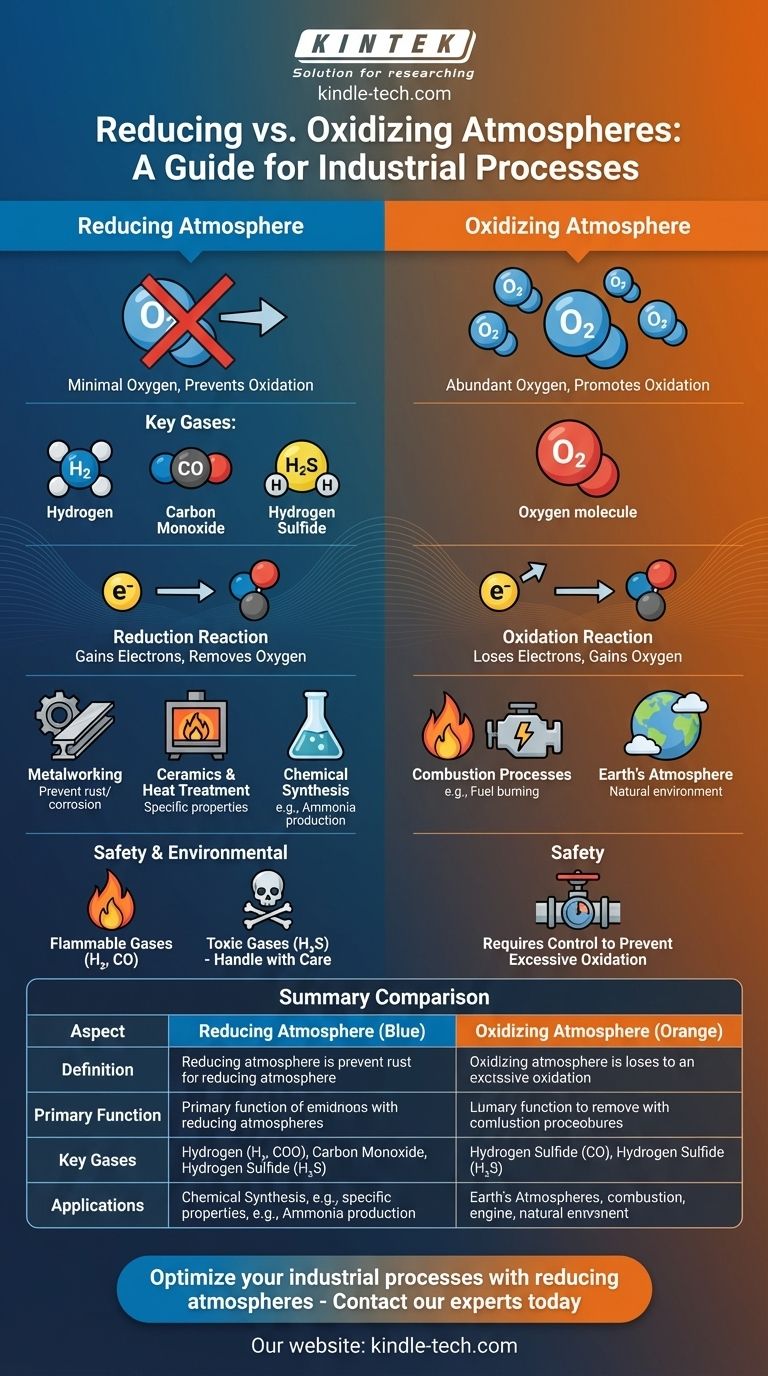
Un'atmosfera riducente è un ambiente gassoso in cui la presenza di ossigeno e altri agenti ossidanti è minimizzata o rimossa, prevenendo i processi di ossidazione. Contiene invece gas come idrogeno, monossido di carbonio e idrogeno solforato, che promuovono reazioni di riduzione. Questo tipo di atmosfera è spesso utilizzato nei processi industriali, come la lavorazione dei metalli e la ceramica, per prevenire l'ossidazione e ottenere specifiche proprietà dei materiali. Al contrario, un'atmosfera ossidante contiene abbondante ossigeno, facilitando le reazioni di ossidazione. Comprendere la distinzione tra queste atmosfere è cruciale per le applicazioni nella scienza dei materiali, nella produzione e negli studi ambientali.

Punti chiave spiegati:
-
Definizione di un'atmosfera riducente:
- Un'atmosfera riducente è caratterizzata dall'assenza o dalla presenza minima di ossigeno e altri gas ossidanti.
- Contiene gas come idrogeno (H₂), monossido di carbonio (CO) e idrogeno solforato (H₂S), che sono in grado di donare elettroni e promuovere reazioni di riduzione.
- Le reazioni di riduzione comportano l'acquisizione di elettroni da parte di una sostanza, spesso portando alla rimozione dell'ossigeno dai composti.
-
Scopo e applicazioni:
- Prevenzione dell'ossidazione: Un'atmosfera riducente viene utilizzata per prevenire l'ossidazione, che può degradare i materiali o alterarne le proprietà. Ad esempio, nella lavorazione dei metalli, aiuta a mantenere l'integrità dei metalli prevenendo ruggine o corrosione.
- Processi industriali: È essenziale in processi come la ricottura, la sinterizzazione e il trattamento termico di metalli e ceramiche, dove sono richieste atmosfere controllate per ottenere specifiche caratteristiche dei materiali.
- Reazioni chimiche: Nella sintesi chimica, un'atmosfera riducente può facilitare reazioni che richiedono la riduzione di composti, come la produzione di ammoniaca (NH₃) da azoto (N₂) e idrogeno (H₂).
-
Confronto con l'atmosfera ossidante:
- Atmosfera ossidante: Questo ambiente contiene abbondante ossigeno, promuovendo reazioni di ossidazione in cui le sostanze perdono elettroni. È comune nei processi di combustione e in ambienti come l'atmosfera terrestre.
-
Differenze chiave:
- Le atmosfere riducenti prevengono l'ossidazione, mentre le atmosfere ossidanti la promuovono.
- Le atmosfere riducenti sono utilizzate in processi in cui l'ossidazione è indesiderabile, mentre le atmosfere ossidanti sono utilizzate dove l'ossidazione è necessaria, come nella combustione del carburante.
-
Esempi di gas riducenti:
- Idrogeno (H₂): Un gas altamente reattivo che dona prontamente elettroni, rendendolo un forte agente riducente.
- Monossido di carbonio (CO): Spesso utilizzato in ambienti industriali per ridurre gli ossidi metallici a metalli puri.
- Idrogeno solforato (H₂S): Un gas riducente che può partecipare a reazioni di riduzione, sebbene sia meno comunemente usato a causa della sua tossicità.
-
Considerazioni ambientali e di sicurezza:
- Manipolazione dei gas riducenti: Molti gas riducenti, come idrogeno e monossido di carbonio, sono infiammabili e richiedono un'attenta manipolazione per prevenire esplosioni o incendi.
- Tossicità: Alcuni gas riducenti, come l'idrogeno solforato, sono tossici e richiedono un'adeguata ventilazione e protocolli di sicurezza.
- Impatto ambientale: L'uso di atmosfere riducenti nei processi industriali deve essere gestito per minimizzare i danni ambientali, come il rilascio di sottoprodotti nocivi.
-
Ruolo in contesti naturali e industriali:
- Atmosfere riducenti naturali: Rare sulla Terra ma possono verificarsi in ambienti specifici, come le sorgenti idrotermali di acque profonde o alcuni habitat microbici.
- Atmosfere riducenti industriali: Comunemente create in ambienti controllati per processi di produzione, come in forni o reattori, per ottenere le proprietà dei materiali o le reazioni chimiche desiderate.
Comprendendo i principi e le applicazioni delle atmosfere riducenti e ossidanti, le industrie possono ottimizzare i processi, migliorare le prestazioni dei materiali e garantire la sicurezza e la conformità ambientale.
Tabella riassuntiva:
| Aspetto | Atmosfera riducente | Atmosfera ossidante |
|---|---|---|
| Definizione | Ossigeno minimo, contiene gas riducenti (es. H₂, CO, H₂S) | Ossigeno abbondante, promuove reazioni di ossidazione |
| Funzione primaria | Previene l'ossidazione, promuove reazioni di riduzione | Facilita le reazioni di ossidazione |
| Applicazioni | Lavorazione dei metalli, ceramica, sintesi chimica, trattamento termico | Processi di combustione, atmosfera terrestre |
| Gas chiave | Idrogeno (H₂), Monossido di carbonio (CO), Idrogeno solforato (H₂S) | Ossigeno (O₂) |
| Considerazioni sulla sicurezza | Gas infiammabili (es. H₂, CO), gas tossici (es. H₂S) richiedono un'attenta manipolazione | Meno pericoloso ma richiede controllo per prevenire un'eccessiva ossidazione |
Ottimizza i tuoi processi industriali con atmosfere riducenti—contatta i nostri esperti oggi stesso per soluzioni su misura!
Guida Visiva
Prodotti correlati
- Fornace a Atmosfera Controllata da 1200℃ Fornace a Atmosfera Inerte di Azoto
- Fornace a atmosfera controllata da 1400℃ con azoto e atmosfera inerte
- Fornace a atmosfera controllata da 1700℃ Fornace a atmosfera inerte di azoto
- Fornace a Idrogeno Inertee Controllato all'Azoto
- Fornace a tubo da laboratorio ad alta temperatura da 1400℃ con tubo in allumina
Domande frequenti
- Come fa un forno a atmosfera divisa a tre zone a garantire l'accuratezza? Padroneggiare l'uniformità termica per i test di trazione
- Qual è la funzione principale di un'atmosfera di azoto controllata in Si3N4 + SiC? Garantire la stabilità superiore della ceramica
- Perché utilizzare un forno a controllo atmosferico di precisione per il ricottura di HEA? Sbloccare dati puri sulla stabilità dei materiali
- Cos'è un'atmosfera ossidante? Approfondimenti chiave sulle reazioni di ossidazione e sulle applicazioni
- Quali condizioni forniscono i forni ad atmosfera ad alta temperatura per il rGO? Ottimizza il tuo processo di riduzione del grafene
- Cosa significa ricotto in idrogeno? Sblocca purezza superiore e prestazioni magnetiche
- Cos'è un forno ad atmosfera speciale? Controllo preciso per il trattamento termico senza ossidazione
- Cos'è l'ossidazione nella brasatura? Come prevenirla per giunti forti e durevoli



















