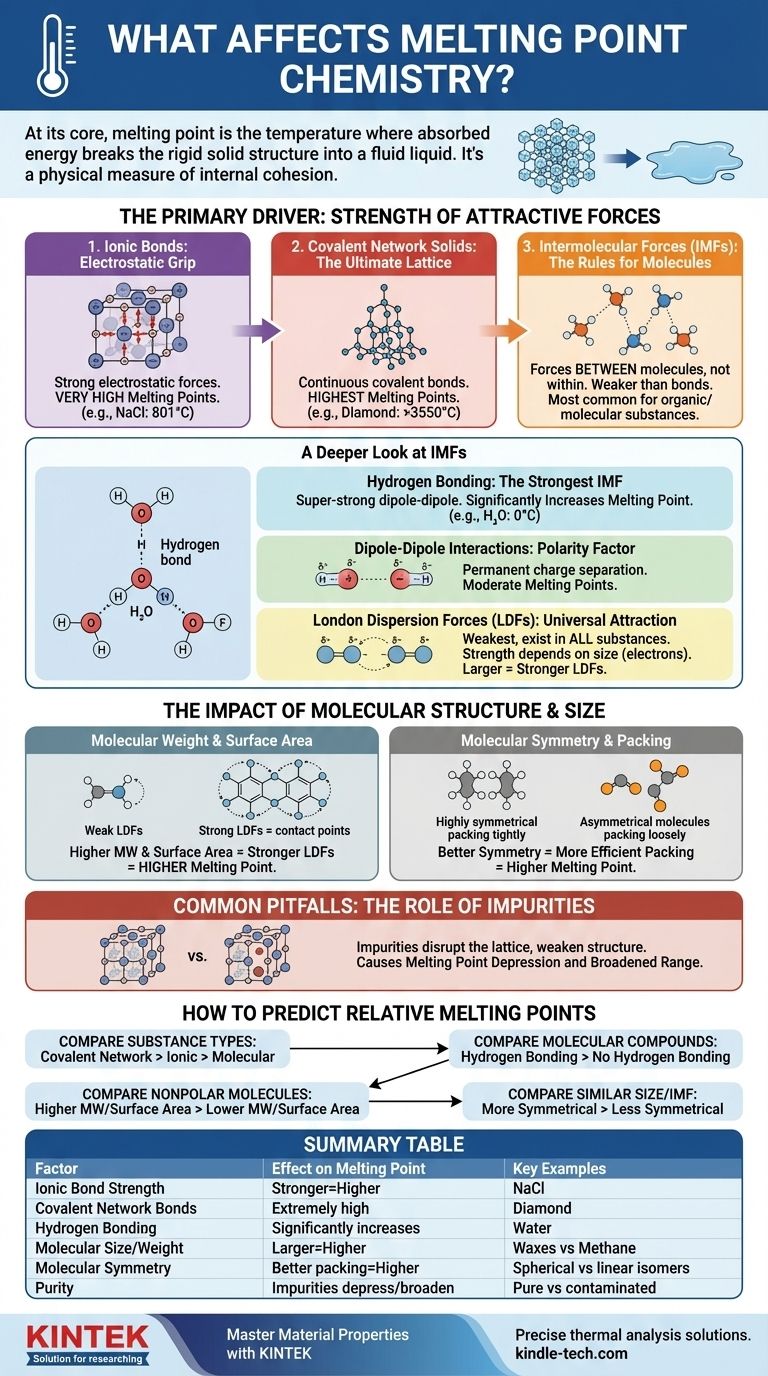
In sintesi, il punto di fusione di una sostanza è la temperatura alla quale essa ha assorbito energia sufficiente per rompere la struttura rigida e ordinata di un solido e passare a un liquido disordinato e fluido. Questo è determinato da due fattori primari: la forza delle forze attrattive che tengono insieme le particelle (atomi, ioni o molecole) e l'efficienza con cui tali particelle si impacchettano in un reticolo cristallino solido.
Il punto di fusione non è solo un numero; è una misura fisica della coesione interna di una sostanza. Per comprenderlo, è necessario prima identificare la forza dominante che tiene insieme le particelle — che sia un potente legame ionico o una debole attrazione intermolecolare — e poi considerare come la dimensione e la forma molecolare affinano tale valore.

Il Fattore Primario: Forza delle Forze Attrattive
La quantità di energia necessaria per rompere un reticolo solido è direttamente proporzionale alla forza delle forze che lo tengono insieme. Queste forze esistono su un vasto spettro, da legami chimici incredibilmente forti a forze intermolecolari molto più deboli.
Legami Ionici: La Presa Elettrostatica
I composti ionici, come il sale da cucina (NaCl), sono tenuti insieme da potenti attrazioni elettrostatiche tra ioni positivi e negativi. Queste forze creano un reticolo cristallino molto stabile.
Superare queste forti attrazioni richiede un'enorme quantità di energia termica, motivo per cui i composti ionici hanno tipicamente punti di fusione molto elevati.
Solidi Reticolari Covalenti: Il Reticolo Definitivo
In un solido reticolare covalente, come il diamante o il quarzo (SiO₂), gli atomi non sono solo attratti l'uno dall'altro; sono uniti da una rete continua di forti legami covalenti. Non ci sono molecole individuali da separare.
Per fondere una tale sostanza, è necessario iniziare a rompere questi potenti legami covalenti. Ciò richiede più energia di qualsiasi altro tipo di interazione, conferendo a questi materiali i punti di fusione più alti di tutte le sostanze.
Forze Intermolecolari (IMFs): Le Regole per le Molecole
Per i composti molecolari (come acqua, zucchero o cera), il punto di fusione non riguarda la rottura dei legami covalenti all'interno delle molecole. Riguarda il superamento delle forze di attrazione più deboli tra le molecole. Queste sono note come forze intermolecolari (IMFs).
Uno Sguardo Più Approfondito alle Forze Intermolecolari (IMFs)
Il tipo e la forza delle IMFs sono il singolo fattore più importante per determinare il punto di fusione della maggior parte delle sostanze organiche e molecolari. Sono generalmente molto più deboli dei legami chimici completi.
Legame a Idrogeno: La IMF Più Forte
Questo è un tipo speciale e super-forte di interazione dipolo-dipolo che si verifica quando l'idrogeno è legato a un atomo altamente elettronegativo come azoto (N), ossigeno (O) o fluoro (F).
L'attrazione risultante tra le molecole è significativa. L'acqua (H₂O) è un classico esempio; i suoi legami a idrogeno le conferiscono un punto di fusione molto più alto (0 °C) di quanto ci si aspetterebbe per una molecola delle sue dimensioni.
Interazioni Dipolo-Dipolo: Il Fattore Polarità
Le molecole polari hanno una separazione permanente di carica, creando un'estremità positiva e una negativa, come minuscoli magneti. Questi "poli" molecolari si attraggono a vicenda.
Queste forze sono più forti delle forze tra molecole non polari di dimensioni simili, portando a punti di fusione moderati.
Forze di Dispersione di London (LDFs): L'Attrazione Universale
Le LDFs sono il tipo più debole di IMF ed esistono in tutte le sostanze. Sorgono dalle fluttuazioni casuali e temporanee nella distribuzione degli elettroni attorno a una molecola, che crea dipoli fugaci e istantanei.
La forza delle LDFs dipende direttamente dalla dimensione della molecola (in particolare, dal suo numero di elettroni). Molecole più grandi hanno nuvole elettroniche più grandi e più "fluttuanti", rendendole più polarizzabili e portando a LDFs più forti. Questo è il motivo per cui molecole grandi e non polari come la cera possono ancora essere solide a temperatura ambiente.
L'Impatto della Struttura e Dimensione Molecolare
Oltre al tipo di forza, la forma e la dimensione specifiche di una molecola giocano un ruolo critico nell'affinamento del suo punto di fusione.
Peso Molecolare e Area Superficiale
Per molecole con la stessa IMF dominante (ad esempio, confrontando due molecole non polari), quella con il peso molecolare più elevato avrà LDFs più forti e quindi un punto di fusione più alto. Una maggiore area superficiale consente più punti di contatto tra le molecole, rafforzando anche le LDFs.
Simmetria Molecolare e Impacchettamento
La simmetria ha un effetto profondo. Molecole altamente simmetriche possono impacchettarsi in modo più efficiente e stretto in un reticolo cristallino stabile, come mattoncini LEGO ben fatti.
Questa disposizione densa e ordinata richiede più energia per essere rotta. Pertanto, una molecola più simmetrica avrà spesso un punto di fusione significativamente più alto rispetto a un isomero meno simmetrico, anche se hanno la stessa formula e peso.
Errori Comuni da Evitare: Il Ruolo delle Impurità
In un contesto pratico e reale, uno dei fattori più comuni che influenzano il punto di fusione è la purezza del campione.
Rottura del Reticolo Cristallino
Le impurità sono particelle estranee che non si adattano perfettamente al reticolo cristallino della sostanza. Introducono difetti e indeboliscono la struttura complessiva.
Poiché il reticolo è già interrotto, richiede meno energia per essere rotto, con conseguente punto di fusione più basso. Questo fenomeno è noto come abbassamento del punto di fusione.
Un Intervallo di Fusione Ampliato
Una sostanza pura tipicamente fonde in un intervallo di temperatura molto ristretto (spesso inferiore a 1 °C). La presenza di impurità non solo abbassa il punto di fusione, ma fa anche sì che la sostanza fonda in un intervallo di temperatura più ampio e esteso. I chimici usano questa caratteristica per valutare la purezza di un composto sintetizzato.
Come Prevedere i Punti di Fusione Relativi
Quando si confrontano due sostanze, seguire questa gerarchia di domande per fare una previsione accurata.
- Se il tuo obiettivo principale è confrontare diversi tipi di sostanze: Un solido reticolare covalente (diamante) avrà un punto di fusione più alto di un composto ionico (sale), che sarà molto più alto di un composto molecolare (zucchero).
- Se il tuo obiettivo principale è confrontare due composti molecolari: Per prima cosa, verifica la presenza di legami a idrogeno. La molecola che può formare legami a idrogeno avrà quasi sempre un punto di fusione più alto di una che non può, supponendo dimensioni simili.
- Se il tuo obiettivo principale è confrontare due molecole non polari: La molecola con il peso molecolare più elevato e una maggiore area superficiale avrà forze di dispersione di London più forti e un punto di fusione più alto.
- Se il tuo obiettivo principale è confrontare due molecole di dimensioni e tipo di IMF simili: La molecola più simmetrica che può impacchettarsi più efficientemente in un reticolo cristallino avrà probabilmente il punto di fusione più alto.
Comprendere questi fattori trasforma il punto di fusione da un semplice dato a un potente indicatore delle forze molecolari fondamentali e della struttura di una sostanza.
Tabella Riassuntiva:
| Fattore | Effetto sul Punto di Fusione | Esempi Chiave |
|---|---|---|
| Forza del Legame Ionico | Legami più forti = Punto di fusione più alto | Cloruro di Sodio (NaCl): 801°C |
| Legami Reticolari Covalenti | Punti di fusione estremamente alti | Diamante: >3550°C |
| Legame a Idrogeno | Aumenta significativamente il punto di fusione | Acqua (H₂O): 0°C |
| Dimensione/Peso Molecolare | Molecole più grandi = Punto di fusione più alto (LDFs più forti) | Cere (alto PM) vs. Metano (basso PM) |
| Simmetria Molecolare | Migliore impacchettamento = Punto di fusione più alto | Isomeri sferici vs. lineari |
| Purezza | Le impurità abbassano e ampliano l'intervallo di fusione | Campioni puri vs. contaminati |
Domina le Proprietà dei Materiali con KINTEK
Comprendere i punti di fusione è fondamentale per la selezione dei materiali, la sintesi e il controllo qualità in laboratorio. Che tu stia sviluppando nuovi composti o analizzando la purezza dei materiali, avere l'attrezzatura giusta è essenziale.
KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio di alta qualità progettati per fornire analisi termiche precise e affidabili. I nostri prodotti aiutano ricercatori e professionisti di laboratorio a determinare con precisione i punti di fusione e a comprendere il comportamento dei materiali.
Pronto a migliorare le capacità del tuo laboratorio? Contatta i nostri esperti oggi stesso per trovare la soluzione perfetta per le tue esigenze di analisi termica.
Guida Visiva
Prodotti correlati
- Fornace per Trattamento Termico Sottovuoto e Fornace per Fusione a Induzione a Levitazione
- Fornace a Induzione Sottovuoto su Scala di Laboratorio
- Sistema di filatura per fusione a induzione sotto vuoto Forno ad arco
- Pressa idraulica riscaldata con piastre riscaldate manuali integrate per uso in laboratorio
- Fornace a fusione a induzione ad arco sotto vuoto non consumabile
Domande frequenti
- Qual è la temperatura di sinterizzazione? Dipende dal punto di fusione del materiale
- Come possiamo rendere la plastica più sostenibile? Una Guida Strategica al Riciclo, alle Bioplastiche e alla Riduzione
- Come si evapora il solvente DMSO? Padroneggia tecniche delicate di alto vuoto per campioni sensibili
- Quali sono i vantaggi dell'utilizzo di un gas inerte per prevenire l'ossidazione nella saldatura? Garantire la resistenza e l'integrità della saldatura
- Qual è la differenza tra VAR e VIM? Variabili Vimscript Legacy vs. API Neovim Moderna
- Come si controlla la temperatura in un esperimento? Padroneggiare precisione, stabilità e uniformità
- Perché la lega di nichel viene scelta per i sistemi fusi di CaCl2-CaF2-CaO? Proteggi i tuoi processi ad alta temperatura
- Quali sono le applicazioni dei sistemi ad aria compressa? Alimentare l'industria dalla produzione al settore farmaceutico





















