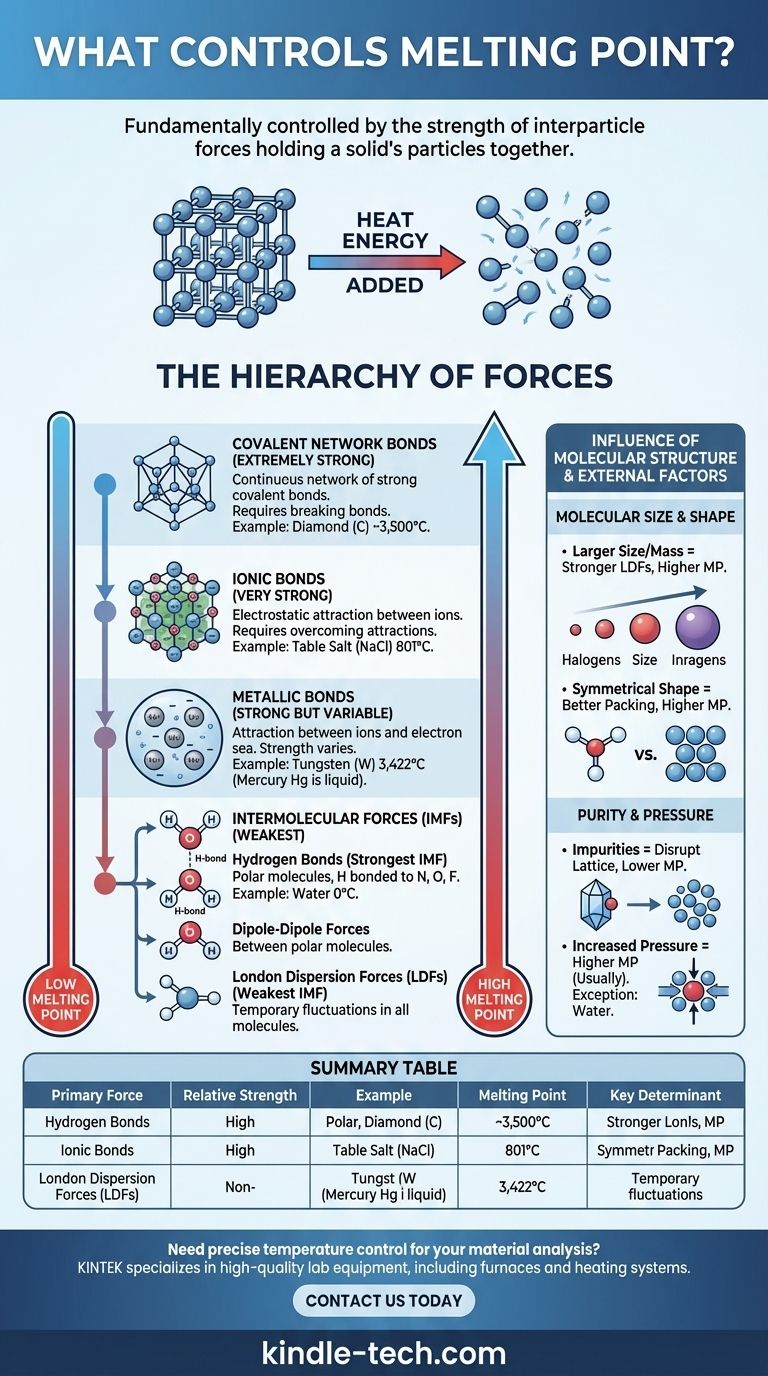
Il punto di fusione di una sostanza è fondamentalmente controllato dalla forza delle forze che tengono unite le sue particelle. In un solido, le particelle (atomi, ioni o molecole) sono bloccate in una disposizione fissa e ordinata chiamata reticolo cristallino. Per fondere il solido, è necessario aggiungere energia termica sufficiente per consentire a queste particelle di superare tali forze e muoversi l'una oltre l'altra come un liquido. Pertanto, forze più forti richiedono più energia per essere rotte, con conseguente punto di fusione più elevato.
Il principio fondamentale è semplice: la fusione non riguarda la rottura delle particelle stesse, ma il superamento delle forze attrattive tra di esse. Il tipo e la forza di queste forze interparticellari, che vanno dai potenti legami ionici alle deboli attrazioni intermolecolari, sono i principali determinanti del punto di fusione di una sostanza.

La Gerarchia delle Forze
L'immensa variazione nei punti di fusione, dal -259°C dell'idrogeno ai 3.422°C del tungsteno, può essere compresa classificando le forze che tengono unito un solido. Queste forze esistono in una chiara gerarchia di forza.
Legami Ionici (Molto Forti)
Nei composti ionici come il sale da cucina (NaCl), le particelle sono ioni con carica positiva e negativa. Sono tenuti insieme da potenti attrazioni elettrostatiche in un rigido reticolo cristallino.
Superare questi forti legami ionici richiede una quantità enorme di energia termica. Di conseguenza, i composti ionici mostrano costantemente punti di fusione molto elevati.
Legami a Rete Covalente (Estremamente Forti)
Nei solidi a rete covalente, gli atomi sono uniti da una vasta e continua rete di forti legami covalenti. Non ci sono molecole individuali; l'intero cristallo è essenzialmente una singola molecola gigante.
Sostanze come il diamante (carbonio) e il quarzo (biossido di silicio) ne sono esempi principali. Per fonderli, è necessario rompere questi legami covalenti estremamente forti, il che richiede enormi quantità di energia, portando a punti di fusione eccezionalmente elevati.
Legami Metallici (Forti ma Variabili)
I metalli sono costituiti da un reticolo di ioni metallici positivi immersi in un "mare" di elettroni delocalizzati che si muovono liberamente attraverso la struttura. L'attrazione tra gli ioni positivi e questo mare di elettroni costituisce il legame metallico.
La forza di questo legame, e quindi il punto di fusione, varia notevolmente. Dipende da fattori come la carica dello ione e il numero di elettroni delocalizzati. Questo è il motivo per cui il mercurio è liquido a temperatura ambiente, mentre il tungsteno ha uno dei punti di fusione più alti di qualsiasi elemento.
Forze Intermolecolari (Le Più Deboli)
Per i composti molecolari (come acqua, zucchero o cera), le forze che devono essere superate per la fusione sono le forze intermolecolari (IMF), ovvero le attrazioni tra molecole separate. Queste sono significativamente più deboli dei legami ionici, covalenti o metallici discussi sopra.
Esistono tre tipi principali di IMF:
- Legami a Idrogeno: Il tipo di IMF più forte. Si verifica in molecole polari in cui l'idrogeno è legato direttamente a un atomo altamente elettronegativo (azoto, ossigeno o fluoro). Il punto di fusione relativamente alto dell'acqua (0°C) è dovuto a questi forti legami a idrogeno.
- Forze Dipolo-Dipolo: Si verificano tra molecole polari che hanno estremità positive e negative permanenti. Queste forze sono più deboli dei legami a idrogeno.
- Forze di Dispersione di London (LDF): L'IMF più debole, presente in tutte le molecole. Derivano da fluttuazioni temporanee e casuali nella distribuzione degli elettroni. Sebbene deboli individualmente, il loro effetto cumulativo può essere significativo nelle molecole più grandi.
L'Influenza della Struttura Molecolare
Oltre al tipo di forza, la dimensione e la forma specifiche delle particelle giocano un ruolo critico, specialmente per i composti molecolari.
Dimensioni e Massa Molecolare
Per i composti con la stessa forza intermolecolare primaria (ad esempio, LDF), le molecole più grandi hanno punti di fusione più elevati. Ciò è dovuto al fatto che le molecole più grandi hanno più elettroni, creando una nuvola elettronica più "polarizzabile" che porta a forze di dispersione di London più forti.
Questa tendenza è chiara negli alogeni: il punto di fusione aumenta man mano che si passa dal fluoro (F₂) allo iodio (I₂).
Forma Molecolare ed Efficienza di Impacchettamento
La capacità di una molecola di impacchettarsi strettamente ed efficientemente in un reticolo cristallino ha un impatto importante. Le molecole simmetriche hanno spesso punti di fusione più elevati rispetto agli isomeri meno simmetrici, anche se hanno la stessa formula e massa.
Le forme simmetriche consentono alle molecole di adattarsi più strettamente nello stato solido, massimizzando l'efficacia delle loro forze intermolecolari. Rompere questa struttura ben organizzata richiede più energia.
Comprendere i Compromessi e le Sfumature
La previsione dei punti di fusione comporta la valutazione di questi fattori interconnessi.
La Purezza Cambia Tutto
I principi sopra descritti presuppongono una sostanza pura. Le impurità interrompono il reticolo cristallino ordinato, indebolendo la struttura complessiva.
Questa interruzione rende il solido più facile da fondere. Di conseguenza, una sostanza impura fonderà a una temperatura più bassa e in un intervallo più ampio rispetto alla sua controparte pura. Questo fenomeno è noto come abbassamento del punto di fusione.
La Pressione Gioca un Ruolo
I punti di fusione sono tipicamente indicati alla pressione atmosferica standard. Per la maggior parte delle sostanze, l'aumento della pressione innalza il punto di fusione perché spinge fisicamente le particelle più vicine, rafforzando la struttura reticolare.
L'acqua è una famosa e critica eccezione. Poiché il ghiaccio solido è meno denso dell'acqua liquida, l'aumento della pressione favorisce la fase liquida più densa, abbassando così il punto di fusione.
Come Applicare Questo alla Tua Analisi
Quando si confrontano le sostanze, utilizzare un approccio sistematico per identificare i fattori chiave in gioco.
- Se il tuo obiettivo principale è confrontare diverse classi di solidi: Per prima cosa, identifica la forza legante primaria: reticolo covalente, ionico, metallico o intermolecolare. Questo ti darà l'indicatore più significativo del punto di fusione relativo.
- Se il tuo obiettivo principale è confrontare due composti molecolari: Determina la forza intermolecolare più forte che ciascuno possiede (legami a idrogeno > dipolo-dipolo > LDF). Il composto con l'IMF più forte avrà generalmente un punto di fusione più elevato.
- Se il tuo obiettivo principale riguarda molecole non polari simili: La molecola con maggiore massa e area superficiale avrà forze di dispersione di London più forti e quindi un punto di fusione più elevato.
- Se il tuo obiettivo principale riguarda isomeri (stessa formula, forma diversa): La molecola più simmetrica che può impacchettarsi più efficientemente in un reticolo cristallino avrà spesso un punto di fusione più elevato.
Comprendendo questa gerarchia di forze e l'influenza della struttura, è possibile spiegare sistematicamente il comportamento di fusione di quasi tutte le sostanze.
Tabella Riassuntiva:
| Tipo di Forza Primaria | Forza Relativa | Sostanza Esempio | Punto di Fusione | Determinante Chiave |
|---|---|---|---|---|
| Rete Covalente | Estremamente Forte | Diamante (C) | ~3.500°C | Rottura dei legami covalenti in un reticolo continuo |
| Legami Ionici | Molto Forte | Cloruro di Sodio (NaCl) | 801°C | Superamento delle attrazioni elettrostatiche tra ioni |
| Legami Metallici | Forte (Variabile) | Tungsteno (W) | 3.422°C | Forza di attrazione ione-mare di elettroni |
| Forze Intermolecolari | La Più Debole | Acqua (H₂O) | 0°C | Legame a idrogeno, dipolo-dipolo, forze di dispersione di London |
Hai bisogno di un controllo preciso della temperatura per l'analisi del tuo materiale? Comprendere i punti di fusione è fondamentale per risultati di laboratorio affidabili. In KINTEK, siamo specializzati in apparecchiature da laboratorio di alta qualità, inclusi forni e sistemi di riscaldamento progettati per un'accurata analisi termica. Sia che tu stia lavorando con metalli ad alto punto di fusione o con composti molecolari sensibili, le nostre soluzioni garantiscono prestazioni costanti. Contattaci oggi per discutere di come i nostri prodotti possono migliorare le capacità del tuo laboratorio e supportare la tua ricerca. Contattaci tramite il nostro modulo di contatto per iniziare!
Guida Visiva
Prodotti correlati
- Fornace a muffola con sollevamento inferiore per laboratorio
- Fornace a muffola da 1800℃ per laboratorio
- Fornace a muffola da 1400℃ per laboratorio
- Fornace a muffola da 1700℃ per laboratorio
- Fornace a tubo da laboratorio ad alta temperatura da 1400℃ con tubo in allumina
Domande frequenti
- Cos'è il processo di sinterizzazione delle polveri? Una guida alla produzione di pezzi a misura (Net-Shape)
- Quali sono le cinque regole della sicurezza chimica? Costruire una cultura proattiva della sicurezza in laboratorio
- Quali sono gli svantaggi della pressatura e sinterizzazione? Comprendere i compromessi nella metallurgia delle polveri
- Cosa causa il singhiozzo (sputtering) in accelerazione? Risolvere l'esitazione del motore e i mancati avviamenti.
- Cosa legge l'FTIR? Sbloccare le impronte molecolari con la spettroscopia infrarossa
- Cos'è il processo HIP del metallo? Ottenere una densità perfetta per componenti critici
- Quali sono i principi di funzionamento del forno ad arco elettrico? Sfruttare la potenza di un arco elettrico per la fusione ad alta temperatura
- Quali sono i vantaggi e gli svantaggi della pirolisi nella gestione dei rifiuti solidi? Una guida alla conversione dei rifiuti in risorse



















