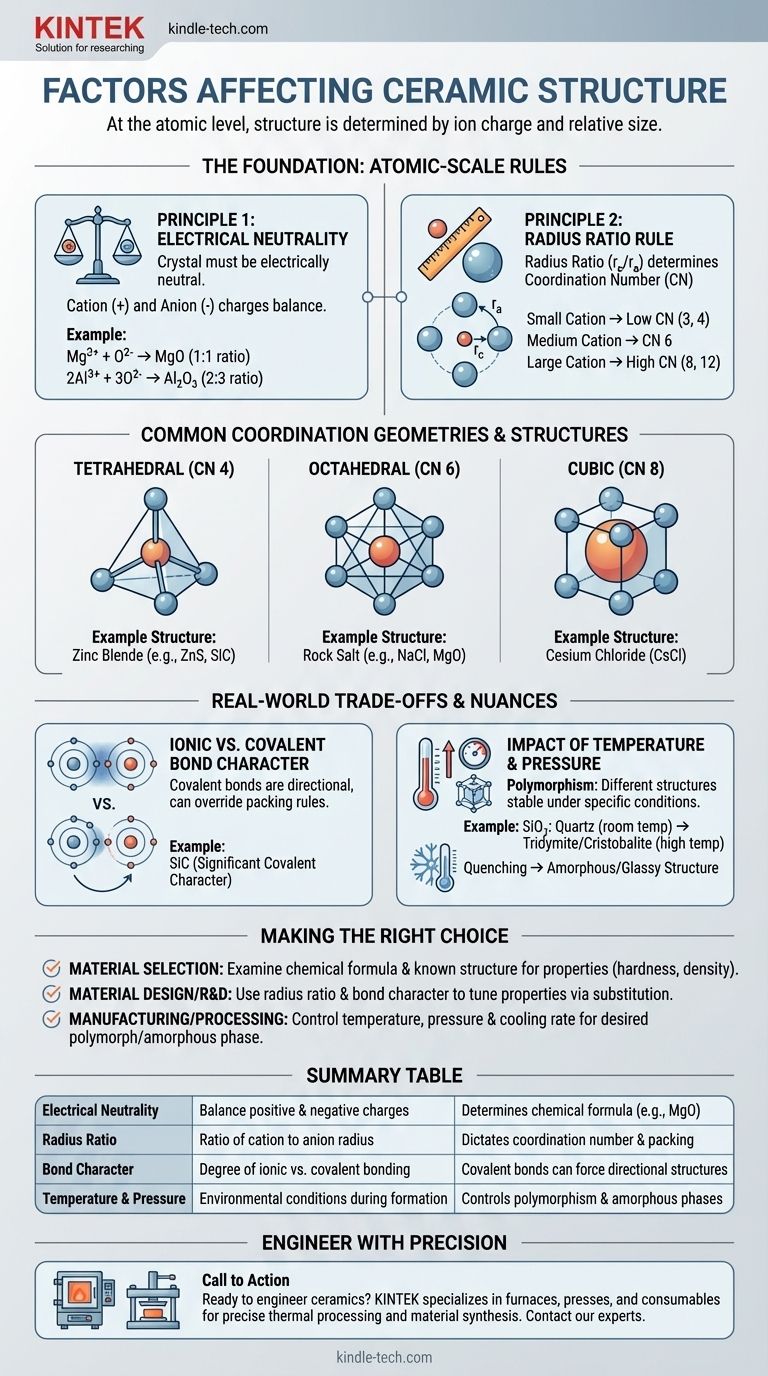
A livello atomico, la struttura cristallina di una ceramica è determinata da due fattori principali: la carica elettrica dei suoi ioni costituenti e la dimensione relativa di tali ioni. Per formare una struttura stabile a bassa energia, la disposizione degli atomi deve soddisfare la neutralità di carica e allo stesso tempo compattarsi nel modo geometricamente più efficiente possibile.
La sfida fondamentale nella formazione di qualsiasi struttura cristallina ceramica è bilanciare le forze in competizione. Cationi e anioni si attraggono, creando strutture dense, ma le loro dimensioni relative dettano la specifica disposizione geometrica — il numero di coordinazione — che può essere fisicamente raggiunta mantenendo la neutralità elettrica complessiva.
Le Fondamenta: Regole a Livello Atomico
Per capire perché una ceramica come l'ossido di magnesio (MgO) forma una struttura mentre il carburo di silicio (SiC) ne forma un'altra, dobbiamo partire dalle due regole non negoziabili che governano il modo in cui gli atomi si dispongono in un reticolo cristallino stabile.
Principio 1: La Regola della Neutralità Elettrica
Il requisito più fondamentale è che il cristallo sia elettricamente neutro. La somma di tutte le cariche positive provenienti dai cationi deve essere precisamente bilanciata dalla somma di tutte le cariche negative provenienti dagli anioni.
Questo principio detta la formula chimica stessa. Ad esempio, poiché uno ione magnesio ha una carica +2 (Mg²⁺) e uno ione ossigeno ha una carica -2 (O²⁻), si combinano in un rapporto di 1:1 per formare MgO. Uno ione alluminio (Al³⁺) e uno ione ossigeno (O²⁻) devono combinarsi in un rapporto di 2:3 per formare Al₂O₃ per raggiungere la neutralità.
Principio 2: La Regola del Rapporto tra i Raggi
Una volta stabilita la formula chimica, subentra la geometria. Il rapporto tra i raggi — il raggio del catione (r_c) diviso per il raggio dell'anione (r_a) — è il fattore critico che determina il numero di coordinazione (NC).
Il numero di coordinazione è semplicemente il numero di anioni che possono compattarsi attorno a un catione centrale. Immagina di cercare di stipare palloni da basket (anioni) attorno a una palla da tennis più piccola (catione). Puoi inserirne solo alcuni prima che inizino a toccarsi tra loro. Se sostituisci la palla da tennis con un pallone da calcio più grande, puoi stiparne di più attorno ad esso. La dimensione relativa detta la geometria di compattazione.
Dal Compattamento Atomico alla Struttura Cristallina
Questi due principi lavorano insieme per produrre i modelli tridimensionali ripetitivi che definiscono le strutture cristalline ceramiche. Il rapporto tra i raggi predice il numero di coordinazione, e la necessità di neutralità di carica detta quindi come queste unità coordinate si collegano nello spazio.
Geometrie di Coordinazione Comuni
Intervalli specifici del rapporto tra i raggi suggeriscono fortemente un numero di coordinazione preferito e la sua forma corrispondente:
- Un catione piccolo si traduce in un NC basso, come 3 (triangolare) o 4 (tetraedrico).
- Un catione di medie dimensioni consente un NC di 6 (ottaedrico).
- Un catione grande, quasi delle dimensioni dell'anione, può raggiungere un NC di 8 (cubico) o anche 12.
Esempi di Strutture Ceramiche Comuni
Queste regole danno origine a strutture cristalline ben note, nominate come minerali comuni. Per le ceramiche semplici di tipo AX (un catione, un anione):
- Struttura del Salgemma (es. NaCl, MgO): Presenta un numero di coordinazione di 6 sia per il catione che per l'anione. È una struttura molto stabile e comune quando il catione e l'anione hanno una differenza di dimensione moderata.
- Struttura del Cloruro di Cesio (CsCl): Si verifica quando il catione è quasi grande quanto l'anione, consentendo un numero di coordinazione più compatto di 8.
- Struttura della Blenda di Zinco (es. ZnS, SiC): Si forma quando il catione è significativamente più piccolo dell'anione, risultando in un numero di coordinazione di 4 (tetraedrico). Questa struttura è anche caratteristica dei materiali con forti legami covalenti.
Per formule più complesse come AₘXₚ (es. Al₂O₃, CaF₂), si applicano gli stessi principi. La struttura diventa semplicemente una disposizione più intricata per garantire che ogni ione raggiunga la sua coordinazione preferita e che la carica complessiva rimanga neutra.
Comprendere i Compromessi e i Limiti
Sebbene questi principi forniscano un quadro potente, rappresentano un modello semplificato. I fattori del mondo reale introducono importanti sfumature che possono alterare la struttura finale.
Il Carattere del Legame Ionico vs. Covalente
La regola del rapporto tra i raggi funziona meglio per i legami puramente ionici. Tuttavia, molte ceramiche, come il carburo di silicio (SiC) e il nitruro di silicio (Si₃N₄), hanno un significativo carattere covalente.
I legami covalenti sono altamente direzionali. Gli atomi preferiscono legarsi ad angoli specifici (es. 109,5° in un tetraedro). In questi materiali, la necessità di soddisfare i legami covalenti direzionali può scavalcare le regole geometriche di compattazione del rapporto tra i raggi, forzando una struttura specifica come la coordinazione tetraedrica.
L'Impatto di Temperatura e Pressione
Un singolo composto chimico può spesso esistere in più strutture cristalline diverse, un fenomeno noto come polimorfismo. Ognuna di queste strutture, o polimorfi, è stabile in un intervallo specifico di temperatura e pressione.
Ad esempio, la silice (SiO₂) esiste come quarzo a temperatura ambiente, ma si trasforma in altri polimorfi come tridimite e cristobalite a temperature più elevate. Queste trasformazioni comportano un riarrangiamento degli atomi in una nuova struttura più stabile per quelle condizioni.
Inoltre, se una ceramica fusa viene raffreddata molto rapidamente (tempra), gli atomi potrebbero non avere abbastanza tempo per disporsi in un reticolo cristallino ordinato. Ciò si traduce in una struttura disordinata, amorfa o vetrosa.
Fare la Scelta Giusta per la Tua Applicazione
Comprendere questi fattori ti permette di collegare la lavorazione e la composizione di una ceramica alla sua struttura finale e, in definitiva, alle sue prestazioni.
- Se la tua priorità principale è la selezione dei materiali: Inizia esaminando la formula chimica e la struttura cristallina nota. Una struttura densa e ad alta coordinazione come il corindone (Al₂O₃) implica elevata durezza e densità, mentre una struttura a coordinazione inferiore può avere proprietà diverse.
- Se la tua priorità principale è la progettazione o la R&S dei materiali: Usa il rapporto tra i raggi e il carattere del legame come tuoi strumenti. La sostituzione di atomi con dimensioni o elettronegatività diverse può essere utilizzata per spostare intenzionalmente la struttura cristallina e mettere a punto le sue proprietà.
- Se la tua priorità principale è la produzione e la lavorazione: Le tue variabili chiave sono la temperatura, la pressione e la velocità di raffreddamento. Usale per controllare quale polimorfo si forma o per decidere tra un prodotto finale cristallino e uno amorfo.
Afferrando l'interazione tra carica, dimensione e condizioni di lavorazione, puoi passare dal semplice utilizzo delle ceramiche all'ingegnerizzazione deliberata per uno scopo specifico.
Tabella Riassuntiva:
| Fattore | Descrizione | Impatto Chiave sulla Struttura |
|---|---|---|
| Neutralità Elettrica | Le cariche positive e negative totali nel cristallo devono bilanciarsi. | Determina la formula chimica (es. MgO, Al₂O₃). |
| Rapporto tra i Raggi | Il rapporto tra il raggio del catione e il raggio dell'anione (r_c/r_a). | Ditta il numero di coordinazione e la geometria di compattazione (es. tetraedrica, ottaedrica). |
| Carattere del Legame | Il grado di legame ionico rispetto a quello covalente. | I legami covalenti possono forzare strutture direzionali, scavalcano le semplici regole di compattazione. |
| Temperatura e Pressione | Le condizioni ambientali durante la formazione e la lavorazione. | Controlla il polimorfismo (diverse forme cristalline) e la formazione di fasi amorfe/vetrose. |
Pronto a progettare ceramiche con precisione? La giusta attrezzatura da laboratorio è fondamentale per controllare i fattori che definiscono la struttura e le prestazioni del tuo materiale. KINTEK è specializzata nei forni, nelle presse e nei materiali di consumo di cui il tuo laboratorio ha bisogno per una lavorazione termica e una sintesi dei materiali precise. Contatta oggi i nostri esperti per discutere come le nostre soluzioni possono aiutarti a raggiungere i tuoi obiettivi specifici sui materiali.
Guida Visiva
Prodotti correlati
- Lastra Ceramica in Carburo di Silicio (SiC) Resistente all'Usura, Ceramica Avanzata Fine Ingegneristica
- Lastra di nitruro di silicio (SiN) lavorata di precisione per la produzione di ceramiche avanzate fini
- Vagli da Laboratorio e Setacciatrici
- Sfera in ceramica di zirconio lavorata di precisione per la produzione avanzata di ceramiche fini
- Dissipatore di calore avanzato in ceramica fine di ossido di alluminio Al2O3 per isolamento
Domande frequenti
- Qual è l'espansione termica del SiC? Domina il suo basso CTE per prestazioni superiori ad alta temperatura
- Qual è il processo di produzione dello zirconio? Dal minerale al metallo e alla ceramica ad alte prestazioni
- Perché la temperatura di fusione della ceramica è più alta di quella della maggior parte dei metalli? Analisi della forza del legame atomico
- Le ceramiche hanno resistenza alla corrosione? Sfrutta la loro natura inerte per applicazioni esigenti
- Quali ceramiche vengono utilizzate per l'isolamento? Scegliere il materiale giusto per esigenze termiche o elettriche
- Qual è la funzione di un rivestimento ceramico in una camera di reazione? Migliorare la precisione dei dati nei test di ossidazione a vapore
- Perché l'uso di refrattari allumino-silicati pone un problema in atmosfere di idrogeno ad alta temperatura?
- Il SiC ha un'alta conduttività termica? Sblocca una gestione termica superiore per l'elettronica di potenza



















