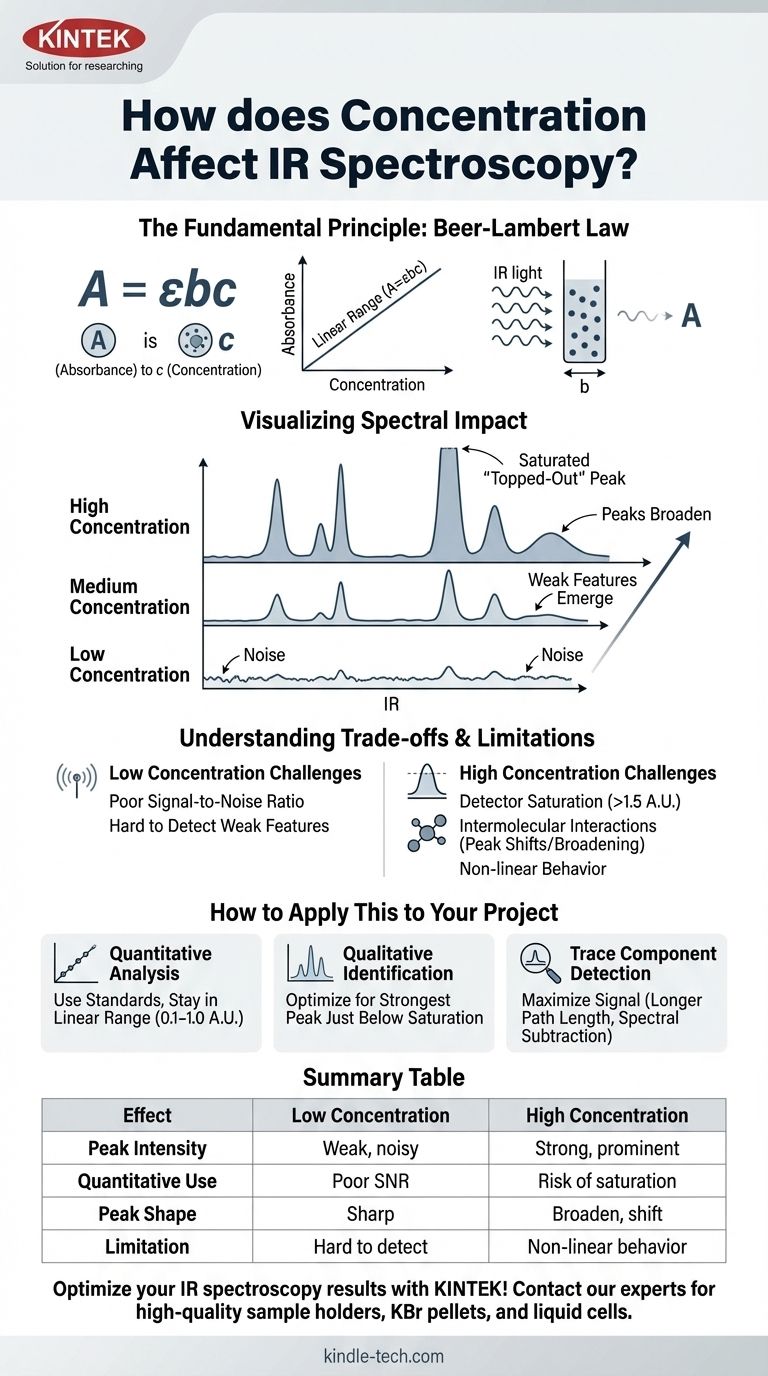
Nella spettroscopia a infrarossi (IR), la concentrazione governa direttamente l'intensità delle bande di assorbimento. Una maggiore concentrazione di un analita in un campione si traduce in un maggiore assorbimento della radiazione IR alle sue frequenze caratteristiche. Ciò fa sì che i picchi corrispondenti nello spettro IR diventino più alti e più prominenti, una relazione descritta matematicamente dalla Legge di Beer-Lambert.
La relazione tra concentrazione e assorbanza IR è potente per l'analisi quantitativa, ma non è perfettamente lineare in tutte le situazioni. Comprendere i suoi limiti pratici, come la saturazione del rivelatore ad alte concentrazioni e gli effetti intermolecolari, è fondamentale per un'accurata interpretazione spettrale e misurazione.
Il Principio Fondamentale: La Legge di Beer-Lambert
La connessione tra concentrazione e assorbanza è la pietra angolare della spettroscopia quantitativa. Fornisce un modello prevedibile su come la luce interagisce con la materia.
Definizione dell'Equazione (A = εbc)
La Legge di Beer-Lambert è espressa come A = εbc.
- A è l'Assorbanza (adimensionale).
- ε (epsilon) è la coefficiente di estinzione molare, una proprietà intrinseca della molecola a una specifica lunghezza d'onda.
- b è il percorso ottico del portacampione (ad esempio, lo spessore di una cella liquida), solitamente in cm.
- c è la concentrazione dell'analita.
Questa equazione mostra che l'assorbanza è direttamente proporzionale alla concentrazione quando il percorso ottico e il coefficiente di estinzione molare sono costanti.
Assorbanza vs. Trasmittanza
Gli strumenti IR misurano fisicamente la Trasmittanza (%T), che è la frazione di luce che passa attraverso il campione. Tuttavia, gli analisti lavorano quasi sempre con l'Assorbanza (A).
Le due sono correlate dalla formula A = -log(T). La rappresentazione grafica dell'assorbanza rispetto alla concentrazione produce una linea retta, che è molto più utile per l'analisi rispetto alla curva esponenziale prodotta dalla trasmittanza.
Visualizzazione dell'Impatto Spettrale
All'aumentare della concentrazione di una sostanza:
- I picchi diventano più alti: I valori di assorbanza di tutti i picchi aumentano.
- Emergono caratteristiche deboli: Piccoli picchi che erano persi nel rumore di fondo a basse concentrazioni diventano visibili.
- I picchi forti si allargano: Le bande di assorbimento molto intense non solo diventano più alte, ma anche più larghe.
Comprendere i Compromessi e i Limiti
La Legge di Beer-Lambert descrive uno scenario ideale. In pratica, diversi fattori possono causare deviazioni da questa relazione lineare, specialmente ad alte concentrazioni.
Il Problema dei Picchi "Saturati"
Quando la concentrazione è troppo alta, un picco può diventare così intenso da assorbire quasi tutta la luce a quella frequenza. L'assorbanza può superare l'intervallo ottimale del rivelatore (tipicamente > 1,5 U.A.).
Ciò fa sì che il picco appaia appiattito o "tagliato" in cima. Tutte le informazioni quantitative in quel picco saturo vengono perse, poiché lo strumento non è più in grado di misurare accuratamente la vera assorbanza.
Interazioni Intermolecolari
Ad alte concentrazioni, le molecole sono più vicine tra loro e possono interagire. Un esempio classico è il legame idrogeno negli alcoli o negli acidi carbossilici.
Queste interazioni possono alterare l'energia vibrazionale dei legami, causando lo spostamento della posizione, il cambiamento di forma o l'allargamento dei picchi. Ciò modifica il coefficiente di estinzione molare (ε), rompendo la semplice relazione lineare tra assorbanza e concentrazione.
Effetti Strumentali
Nessuno strumento è perfetto. Una piccola quantità di luce diffusa può raggiungere il rivelatore senza passare attraverso il campione. Ciò fa sì che le letture di assorbanza si appiattiscano ad alte concentrazioni, portando a una curva che si piega verso l'asse x anziché rimanere lineare.
La Sfida delle Basse Concentrazioni
Al contrario, se un campione è troppo diluito, l'assorbanza potrebbe essere troppo bassa per essere distinta dal rumore di fondo dello strumento. Il cattivo rapporto segnale-rumore rende inaffidabili sia l'identificazione qualitativa che la misurazione quantitativa.
Come Applicarlo al Tuo Progetto
Il tuo approccio alla concentrazione del campione dipende interamente dal tuo obiettivo analitico. Devi preparare il tuo campione in modo da ottimizzare lo spettro per il tuo scopo specifico.
- Se il tuo obiettivo principale è l'analisi quantitativa: Prepara una serie di standard e crea una curva di calibrazione, assicurandoti che l'assorbanza del tuo campione sconosciuto rientri nell'intervallo lineare della tua curva (tipicamente 0,1–1,0 U.A.).
- Se il tuo obiettivo principale è l'identificazione qualitativa: Regola la preparazione del campione (ad esempio, quantità in una pastiglia di KBr, percorso ottico di una cella liquida) per ottenere uno spettro in cui il picco più forte sia appena al di sotto della saturazione, assicurando che le bande dei gruppi funzionali più deboli siano chiaramente visibili.
- Se il tuo obiettivo principale è rilevare un componente in traccia: Utilizza tecniche che massimizzino il segnale dell'analita, come l'impiego di celle a percorso ottico più lungo o l'esecuzione di sottrazioni spettrali per rimuovere l'interferenza di un solvente o di una matrice.
In definitiva, controllare e comprendere la concentrazione è la chiave per trasformare uno spettro IR da una semplice impronta digitale a un preciso strumento analitico.
Tabella Riassuntiva:
| Effetto della Concentrazione | Bassa Concentrazione | Alta Concentrazione |
|---|---|---|
| Intensità del Picco | Picchi deboli e rumorosi | Picchi forti e prominenti |
| Uso Quantitativo | Scarso rapporto segnale-rumore | Rischio di saturazione del rivelatore |
| Forma del Picco | Netta, ben definita | Può allargarsi e spostarsi |
| Limitazione Chiave | Difficile da rilevare | Comportamento non lineare di Beer-Lambert |
Ottimizza i tuoi risultati di spettroscopia IR con KINTEK!
Sia che tu stia eseguendo un'analisi quantitativa precisa o che tu abbia bisogno di un'identificazione qualitativa affidabile, la corretta preparazione del campione è fondamentale. KINTEK è specializzata in attrezzature e materiali di consumo di alta qualità per laboratori, inclusi portacampioni IR, pastiglie di KBr e celle liquide progettate per aiutarti a ottenere la concentrazione e il percorso ottico ottimali per spettri chiari e accurati.
Contatta oggi i nostri esperti per discutere le tue specifiche esigenze di laboratorio e scoprire come le nostre soluzioni possono migliorare il tuo flusso di lavoro spettroscopico e l'affidabilità dei dati.
Guida Visiva
Prodotti correlati
- Biossido di iridio IrO2 per elettrolisi dell'acqua
- Lente in silicio monocristallino ad alta resistenza infrarossa
- Fornace di Grafite Sottovuoto IGBT Fornace Sperimentale di Grafizzazione
- Substrato in zaffiro con rivestimento a trasmissione infrarossa
- Substrato di Vetro per Finestre Ottiche Fogli di Solfuro di Zinco ZnS
Domande frequenti
- In che modo la biomassa è meno costosa? Sfruttare il potere delle materie prime a basso costo e locali
- Perché è necessario un forno da laboratorio per l'essiccazione preliminare dei fotocatalizzatori di zeolite-titanato? Garantire l'integrità strutturale
- Qual è il materiale più comunemente usato nei semiconduttori? Scopri perché il silicio domina l'elettronica moderna
- La biomassa può sostituire il carbone? La complessa realtà di un'alternativa energetica verde
- Qual è la temperatura di sinterizzazione di un forno? La chiave specifica del materiale per risultati perfetti
- Quali sono i 3 tipi di fonti di energia da biomassa? Sblocca il potenziale dei materiali organici
- Perché è necessaria un'attrezzatura di riscaldamento a temperatura controllata precisa per la sintesi della chitosana? Garantire una deacetilazione di alta qualità
- Quali sono le attrezzature per il laboratorio di pirolisi? Scegliere il reattore giusto per la vostra ricerca
















