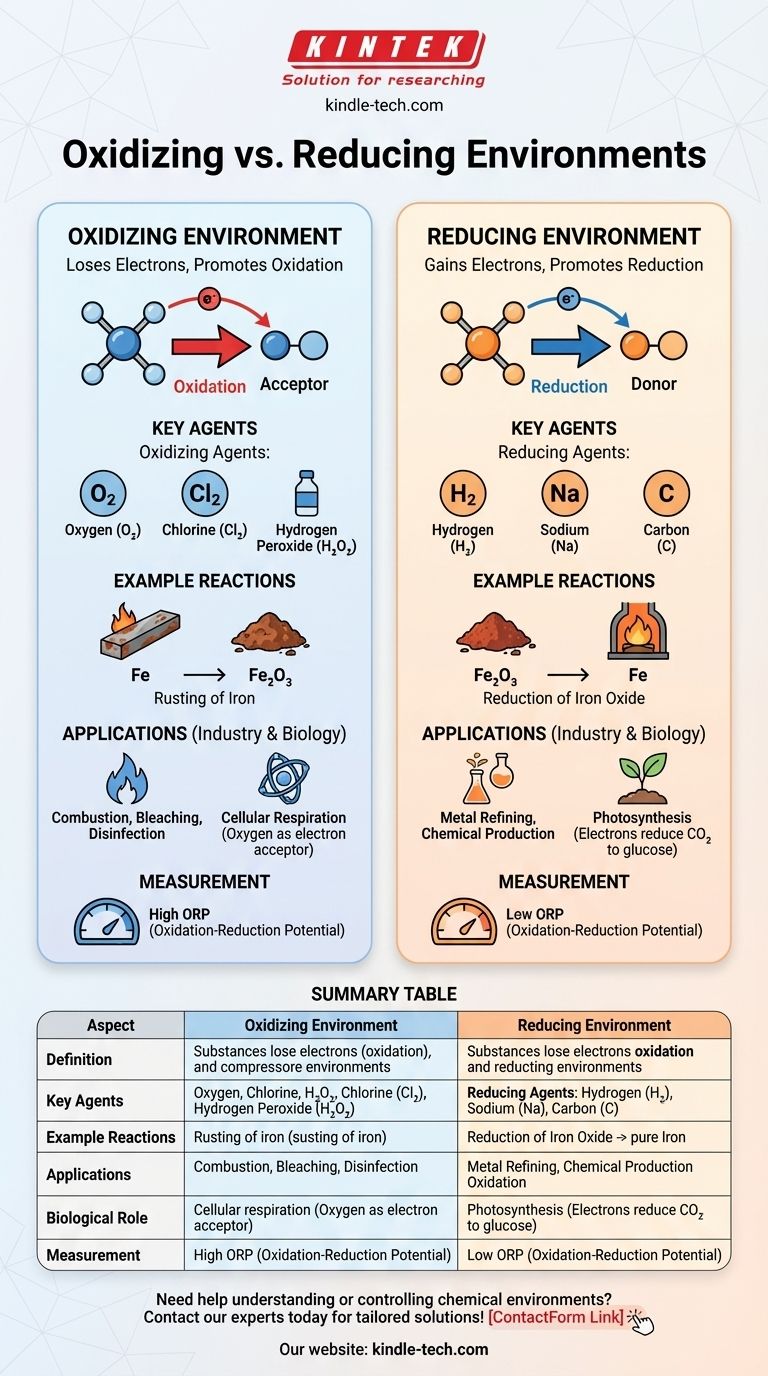
In chimica, un ambiente ossidante è quello in cui le sostanze tendono a perdere elettroni, promuovendo reazioni di ossidazione, mentre un ambiente riducente è quello in cui le sostanze tendono ad acquisire elettroni, promuovendo reazioni di riduzione. La differenza chiave risiede nella disponibilità di accettori di elettroni (agenti ossidanti) o donatori di elettroni (agenti riducenti). Gli ambienti ossidanti sono caratterizzati dalla presenza di agenti ossidanti come ossigeno o alogeni, che facilitano la perdita di elettroni. Al contrario, gli ambienti riducenti contengono agenti riducenti come idrogeno o metalli, che facilitano l'acquisizione di elettroni. Questi ambienti svolgono ruoli critici nelle reazioni chimiche, nei processi industriali e nei sistemi biologici.

Punti chiave spiegati:
-
Definizione di ambienti ossidanti e riducenti:
- Ambiente ossidante: Un ambiente chimico in cui le sostanze hanno maggiori probabilità di perdere elettroni, portando all'ossidazione. Questo ambiente è ricco di agenti ossidanti, come ossigeno, cloro o altri accettori di elettroni.
- Ambiente riducente: Un ambiente chimico in cui le sostanze hanno maggiori probabilità di acquisire elettroni, portando alla riduzione. Questo ambiente è ricco di agenti riducenti, come idrogeno, metalli o altri donatori di elettroni.
-
Ruolo degli agenti ossidanti e riducenti:
- Agenti ossidanti: Sono sostanze che accettano elettroni da altre sostanze, ossidandole. Esempi comuni includono ossigeno (O₂), cloro (Cl₂) e perossido di idrogeno (H₂O₂).
- Agenti riducenti: Sono sostanze che donano elettroni ad altre sostanze, riducendole. Esempi comuni includono idrogeno (H₂), sodio (Na) e carbonio (C).
-
Reazioni chimiche in ambienti diversi:
- Ambiente ossidante: In un tale ambiente, le reazioni di ossidazione dominano. Ad esempio, la ruggine del ferro si verifica in un ambiente ossidante dove il ferro (Fe) perde elettroni a favore dell'ossigeno, formando ossido di ferro (Fe₂O₃).
- Ambiente riducente: In un tale ambiente, le reazioni di riduzione dominano. Ad esempio, la riduzione degli ossidi metallici a metalli puri si verifica in un ambiente riducente, come quando il carbonio viene utilizzato per ridurre l'ossido di ferro a ferro in un altoforno.
-
Applicazioni nell'industria e nella biologia:
- Applicazioni industriali: Gli ambienti ossidanti sono utilizzati in processi come la combustione, lo sbiancamento e la disinfezione. Gli ambienti riducenti sono cruciali in processi come la raffinazione dei metalli e la produzione di alcune sostanze chimiche.
- Sistemi biologici: Nei sistemi biologici, gli ambienti ossidanti si trovano in processi come la respirazione cellulare, dove l'ossigeno agisce come accettore finale di elettroni. Gli ambienti riducenti si trovano in processi come la fotosintesi, dove gli elettroni vengono donati per ridurre l'anidride carbonica a glucosio.
-
Misurazione e controllo:
- Potenziale di ossidoriduzione (ORP): L'ORP è una misura della tendenza di un ambiente chimico a guadagnare o perdere elettroni. Un ORP elevato indica un ambiente ossidante, mentre un ORP basso indica un ambiente riducente.
- Controllo nei processi industriali: Nelle industrie, il controllo della natura ossidante o riducente dell'ambiente è cruciale per ottimizzare le reazioni chimiche, garantire la qualità del prodotto e prevenire reazioni collaterali indesiderate.
-
Esempi di ambienti ossidanti e riducenti:
- Ambiente ossidante: L'atmosfera terrestre è un ambiente ossidante a causa della presenza di ossigeno. Questo è il motivo per cui metalli come il ferro si corrodono se esposti all'aria.
- Ambiente riducente: L'interno di un altoforno è un ambiente riducente dove il monossido di carbonio (CO) agisce come agente riducente per convertire il minerale di ferro (Fe₂O₃) in ferro metallico (Fe).
Comprendendo le differenze tra ambienti ossidanti e riducenti, chimici e ingegneri possono controllare e ottimizzare meglio le reazioni chimiche in varie applicazioni, dai processi industriali ai sistemi biologici.
Tabella riassuntiva:
| Aspetto | Ambiente ossidante | Ambiente riducente |
|---|---|---|
| Definizione | Le sostanze perdono elettroni (ossidazione) a causa di accettori di elettroni come ossigeno o alogeni. | Le sostanze acquisiscono elettroni (riduzione) a causa di donatori di elettroni come idrogeno o metalli. |
| Agenti chiave | Agenti ossidanti: Ossigeno (O₂), cloro (Cl₂), perossido di idrogeno (H₂O₂). | Agenti riducenti: Idrogeno (H₂), sodio (Na), carbonio (C). |
| Esempi di reazioni | Ruggine del ferro (Fe → Fe₂O₃). | Riduzione dell'ossido di ferro a ferro (Fe₂O₃ → Fe). |
| Applicazioni | Combustione, sbiancamento, disinfezione. | Raffinazione dei metalli, produzione chimica. |
| Ruolo biologico | Respirazione cellulare (ossigeno come accettore di elettroni). | Fotosintesi (gli elettroni riducono la CO₂ a glucosio). |
| Misurazione | Potenziale di ossidoriduzione (ORP) elevato. | Potenziale di ossidoriduzione (ORP) basso. |
Hai bisogno di aiuto per comprendere o controllare gli ambienti chimici? Contatta i nostri esperti oggi stesso per soluzioni su misura!
Guida Visiva
Prodotti correlati
- Fornace a Idrogeno Inertee Controllato all'Azoto
- Apparecchiatura per macchine HFCVD per rivestimento di nano-diamante per matrici di trafilatura
- Sistema di apparecchiature per forni a tubo CVD personalizzati versatili per deposizione chimica da vapore
- Fornace a Induzione Sottovuoto su Scala di Laboratorio
- Fornace di Grafittizzazione per Materiali Negativi per Forno Sottovuoto in Grafite
Domande frequenti
- Perché è necessario un forno industriale con controllo dell'atmosfera di idrogeno per il pre-sintering dei materiali Fe-Cr-Al?
- Cos'è la ricottura in idrogeno? Ottieni proprietà dei materiali superiori con la ricottura brillante
- Perché è necessaria un'atmosfera riducente all'idrogeno per la ricottura del tungsteno? Garantire la purezza nella lavorazione ad alta temperatura
- Quali sono i principali vantaggi dell'utilizzo della sinterizzazione a idrogeno per le parti? Raggiungere la massima densità e resistenza alla corrosione
- Perché è necessaria una fornace ad atmosfera di idrogeno per il composito W-Cu? Sblocca un'infiltrazione e una densità superiori












