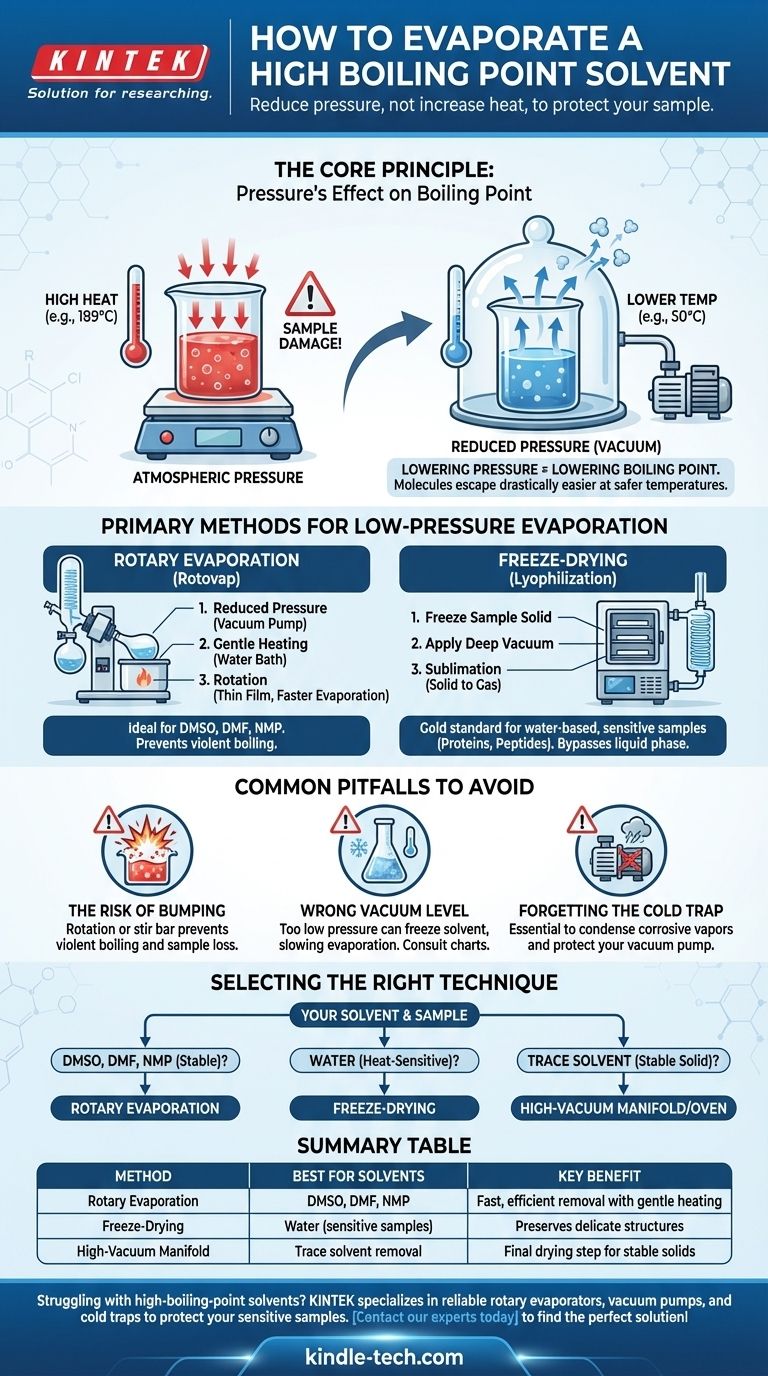
Evaporare un solvente ad alto punto di ebollizione è una sfida comune in laboratorio, dove la semplice aggiunta di più calore è spesso controproducente e può distruggere il campione. La soluzione non è forzare l'evaporazione con alte temperature, ma cambiare l'ambiente riducendo significativamente la pressione. Questo abbassa il punto di ebollizione del solvente, permettendogli di vaporizzare delicatamente ed efficientemente a una temperatura molto più sicura e bassa.
Il principio fondamentale è questo: invece di combattere l'alto punto di ebollizione del solvente con calore distruttivo, si cambiano le regole del gioco. Applicando il vuoto, si rende drasticamente più facile per le molecole di solvente sfuggire, consentendo una rapida evaporazione a o vicino alla temperatura ambiente.

Il Principio Fondamentale: L'Effetto della Pressione sul Punto di Ebollizione
Per rimuovere efficacemente un solvente ad alto punto di ebollizione, devi prima comprendere la fisica in gioco. Il processo è interamente governato dalla relazione tra temperatura, pressione e lo stato fisico del solvente.
Cosa Definisce un Punto di Ebollizione?
Un liquido bolle alla temperatura in cui la sua tensione di vapore—la pressione esercitata dalla sua forma gassosa—eguaglia la pressione dell'ambiente circostante.
Al livello del mare, l'acqua bolle a 100°C perché quella è la temperatura alla quale la sua tensione di vapore eguaglia la pressione atmosferica standard (~760 torr).
La Relazione Pressione-Temperatura
L'intuizione chiave è che se si può abbassare la pressione ambientale, si abbassa anche la temperatura richiesta affinché il solvente bolla.
Pensala come rimuovere un coperchio pesante da un contenitore. Con meno pressione che spinge sulla superficie del liquido, le sue molecole possono sfuggire nella fase gassosa molto più facilmente e con meno energia (calore).
Perché Questo Protegge il Tuo Campione
Molti composti chimici, specialmente molecole organiche complesse o materiali biologici, sono termicamente sensibili.
Applicare l'alto calore necessario per far bollire qualcosa come il DMSO (punto di ebollizione: 189°C) a pressione atmosferica causerebbe quasi certamente decomposizione, reazioni secondarie o polimerizzazione, distruggendo il tuo prodotto finale. L'evaporazione a bassa pressione evita tutto questo.
Metodi Principali per l'Evaporazione a Bassa Pressione
I laboratori utilizzano attrezzature specializzate progettate per sfruttare la relazione pressione-temperatura. I due metodi più comuni sono l'evaporazione rotante e la liofilizzazione.
L'Evaporatore Rotante ("Rotovap")
Un evaporatore rotante è il cavallo di battaglia più comune per questo compito. Rimuove efficacemente i solventi combinando tre azioni contemporaneamente.
- Pressione Ridotta: Una pompa a vuoto abbassa la pressione all'interno del sistema.
- Riscaldamento Delicato: Un bagno d'acqua fornisce un livello di calore controllato e basso al pallone.
- Rotazione: La rotazione del pallone stende il campione in un film sottile, aumentando drasticamente la superficie per un'evaporazione più rapida e prevenendo l'ebollizione violenta (urti).
Questo metodo è ideale per rimuovere comuni solventi organici ad alto punto di ebollizione come DMSO, DMF e NMP.
Liofilizzazione (Freeze-Drying)
Per i campioni più sensibili, specialmente quelli in acqua, la liofilizzazione è lo standard d'oro. Questo processo bypassa completamente la fase liquida.
Innanzitutto, il campione viene congelato solidamente. Quindi, viene applicato un vuoto molto profondo. In queste condizioni, il solvente congelato sublima—trasformandosi direttamente da solido a gas—che viene poi catturato da un condensatore estremamente freddo.
Questa tecnica è essenziale per preservare la struttura di materiali delicati come proteine, peptidi e nanoparticelle che verrebbero danneggiati da qualsiasi quantità di calore o dallo stress fisico dell'evaporazione convenzionale.
Errori Comuni da Evitare
Sebbene potenti, queste tecniche richiedono una corretta esecuzione per essere efficaci e sicure. Comprendere i potenziali problemi è fondamentale per il successo.
Il Rischio di "Urto" (Bumping)
Sotto vuoto, un liquido può a volte surriscaldarsi ed ebollire in modo esplosivo in un fenomeno chiamato urto. Questo può causare la perdita di una parte significativa del campione nel condensatore.
La rotazione di un rotovap è la difesa primaria contro gli urti. Per i sistemi a vuoto statici, l'aggiunta di un'ancoretta magnetica può aiutare.
Scegliere il Giusto Livello di Vuoto
Più vuoto non è sempre meglio. Se la pressione è troppo bassa, si può accidentalmente congelare il solvente nel pallone (un problema comune con l'acqua su un rotovap), il che rallenta drasticamente l'evaporazione.
Consultare sempre una tabella della tensione di vapore o un nomogramma per il solvente specifico per trovare le impostazioni ottimali di temperatura e pressione.
La Trappola a Freddo è Non Negoziabile
Una trappola a freddo—un condensatore raffreddato con ghiaccio secco/acetone o azoto liquido—deve essere sempre posizionata tra l'apparato e la pompa a vuoto.
I vapori di solvente sono altamente corrosivi e distruggeranno l'olio e i componenti interni di una pompa non protetta. La trappola a freddo condensa questi vapori in un liquido o solido, risparmiandoti una riparazione molto costosa.
Selezione della Tecnica Giusta per il Tuo Solvente
La scelta del metodo dipende interamente dal solvente che stai rimuovendo e dalla sensibilità del tuo composto.
- Se il tuo solvente è DMSO, DMF o NMP: Un evaporatore rotante collegato a una pompa a vuoto adeguata e protetto da una trappola a freddo è il metodo standard del settore.
- Se il tuo solvente è acqua e il tuo campione è altamente sensibile al calore (es. una proteina): La liofilizzazione è la scelta superiore per preservarne la struttura delicata.
- Se stai rimuovendo quantità finali e tracce di solvente da un solido stabile: Un collettore ad alto vuoto (linea Schlenk) o un forno a vuoto possono essere utilizzati per la fase finale di essiccazione dopo la rimozione in massa.
La padronanza del controllo della pressione è la chiave per isolare efficientemente il tuo composto puro senza compromessi.
Tabella Riepilogativa:
| Metodo | Ideale per Solventi | Beneficio Chiave |
|---|---|---|
| Evaporazione Rotante | DMSO, DMF, NMP | Rimozione rapida ed efficiente con riscaldamento delicato |
| Liofilizzazione | Acqua (per campioni sensibili) | Preserva strutture delicate come le proteine |
| Collettore ad Alto Vuoto | Rimozione di tracce di solvente | Fase finale di essiccazione per solidi stabili |
Hai difficoltà con solventi ad alto punto di ebollizione? KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio, fornendo evaporatori rotanti, pompe a vuoto e trappole a freddo affidabili per garantire che i tuoi campioni sensibili siano protetti durante l'evaporazione. La nostra esperienza aiuta laboratori come il tuo a ottenere composti puri e intatti in modo efficiente. Contatta i nostri esperti oggi per trovare la soluzione di evaporazione perfetta per le tue esigenze!
Guida Visiva
Prodotti correlati
- Pompa per vuoto ad acqua circolante per uso di laboratorio e industriale
- Pompa per vuoto rotativa a palette da laboratorio per uso in laboratorio
- Pompa per vuoto a membrana oil-free per uso di laboratorio e industriale
- Pressa termica idraulica elettrica riscaldata a vuoto per laboratorio
- Macchina per Stampa a Freddo Sottovuoto per la Preparazione dei Campioni
Domande frequenti
- Quali sono i vantaggi di una pompa per vuoto a circolazione d'acqua? Durata superiore per ambienti di laboratorio esigenti
- Quali tipi di gas può gestire una pompa per vuoto a circolazione d'acqua? Gestione sicura di gas infiammabili, condensabili e sporchi
- In che modo la rotazione della girante influisce sul flusso di gas in una pompa da vuoto a circolazione d'acqua? Una guida al principio dell'anello liquido
- Perché una pompa per vuoto a circolazione d'acqua è adatta per la gestione di gas infiammabili o esplosivi? Sicurezza intrinseca tramite compressione isotermica
- Qual è l'importanza di una pompa per vuoto per le interfacce ibride di tipo Schottky? Raggiungere purezza e legame a livello atomico



















