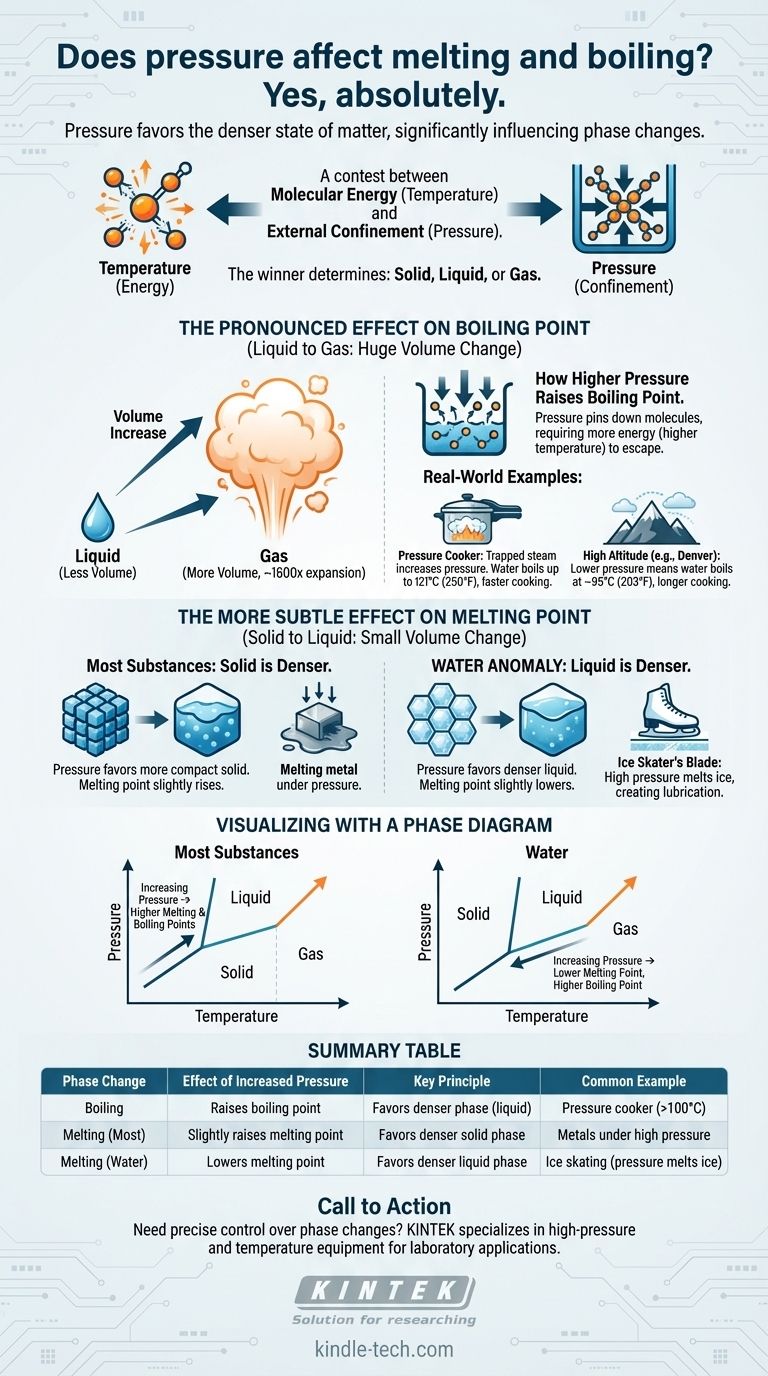
Sì, assolutamente. La pressione è un fattore critico che influenza direttamente le temperature a cui le sostanze cambiano fase. L'aumento della pressione esterna generalmente innalza significativamente il punto di ebollizione di un liquido. Il suo effetto sul punto di fusione è più sottile ma segue un principio chiaro: la pressione favorisce lo stato della materia più denso.
Il principio fondamentale è una contesa tra l'energia molecolare (temperatura) e il confinamento esterno (pressione). La temperatura fornisce alle molecole l'energia per liberarsi in uno stato meno ordinato, mentre la pressione le costringe in uno stato più compatto e denso. Il vincitore di questa contesa determina se una sostanza è solida, liquida o gassosa.

Perché la pressione influenza i cambiamenti di fase
La battaglia tra energia e confinamento
Un cambiamento di fase, come la fusione o l'ebollizione, si verifica quando le molecole acquisiscono sufficiente energia termica per superare le forze che le tengono in una struttura fissa. La temperatura fornisce questa energia.
La pressione, d'altra parte, è una forza esterna che spinge le molecole l'una verso l'altra. Agisce come una forma di confinamento, rendendo più difficile per le molecole espandersi e passare a una fase meno densa.
Una questione di volume e densità
La chiave per comprendere l'effetto della pressione risiede nel volume. Quando una sostanza fonde o bolle, il suo volume e la sua densità cambiano.
La pressione favorirà sempre la fase che occupa meno volume: la fase più densa. Questa singola regola spiega perché la pressione influisce diversamente sull'ebollizione e sulla fusione.
L'effetto pronunciato sul punto di ebollizione
Da liquido a gas: un enorme cambiamento di volume
La transizione da liquido a gas comporta un enorme aumento di volume. Una singola goccia d'acqua, ad esempio, si espande per riempire uno spazio oltre 1.600 volte più grande quando diventa vapore.
Poiché questo cambiamento di volume è così grande, la pressione ha un impatto molto forte e diretto sul punto di ebollizione.
Come una pressione più elevata aumenta il punto di ebollizione
Quando si aumenta la pressione sulla superficie di un liquido, si stanno essenzialmente "bloccando" le molecole. Ora richiedono molta più energia cinetica (una temperatura più alta) per sfuggire nella fase gassosa.
Questo è il motivo per cui il punto di ebollizione di quasi tutte le sostanze aumenta all'aumentare della pressione.
Esempio pratico: la pentola a pressione
Una pentola a pressione funziona sigillando una pentola, intrappolando il vapore prodotto dall'acqua bollente. Questo vapore intrappolato aumenta drasticamente la pressione all'interno.
Sotto questa alta pressione, il punto di ebollizione dell'acqua può salire da 100°C (212°F) fino a 121°C (250°F). Quest'acqua più calda trasferisce il calore più rapidamente, riducendo drasticamente i tempi di cottura.
Esempio pratico: cucinare ad alta quota
L'opposto accade ad alta quota. A Denver, Colorado (a 5.280 piedi), la pressione atmosferica è inferiore.
Con meno pressione atmosferica che trattiene le molecole d'acqua, queste possono sfuggire più facilmente allo stato gassoso. L'acqua bolle lì a circa 95°C (203°F), il che significa che il cibo deve essere cotto per un tempo più lungo.
L'effetto più sottile sul punto di fusione
Da solido a liquido: un piccolo cambiamento di volume
In contrasto con l'ebollizione, il cambiamento di volume durante la fusione è molto piccolo. Le densità di una sostanza nelle sue forme solida e liquida sono solitamente abbastanza simili.
Poiché il cambiamento di volume è minimo, la pressione ha un effetto molto meno drammatico sul punto di fusione.
Per la maggior parte delle sostanze: una pressione più elevata aumenta il punto di fusione
La maggior parte dei materiali, dai metalli alle cere all'anidride carbonica, è più densa nella sua forma solida che in quella liquida.
In questi casi, l'aumento della pressione favorisce la fase solida più compatta. Questo rende leggermente più difficile la fusione, quindi è necessaria una temperatura più elevata. Il punto di fusione aumenta con la pressione.
L'anomalia dell'acqua: un'eccezione cruciale
L'acqua è un'eccezione notevole e rara. L'acqua solida (ghiaccio) è meno densa dell'acqua liquida, motivo per cui il ghiaccio galleggia.
Poiché l'acqua liquida è la fase più densa, l'aumento della pressione sul ghiaccio favorisce la formazione di liquido. Ciò significa che sotto alta pressione, il ghiaccio si scioglierà a una temperatura inferiore a 0°C (32°F).
Esempio pratico: la lama del pattino da ghiaccio
La classica illustrazione di questo principio è il pattinatore sul ghiaccio. La lama sottile del pattino concentra l'intero peso del pattinatore su una piccola area, creando un'immensa pressione sul ghiaccio.
Questa alta pressione fa sì che il ghiaccio direttamente sotto la lama si sciolga a una temperatura leggermente inferiore, creando uno strato microscopico d'acqua che lubrifica il percorso della lama.
Comprendere i compromessi: visualizzare con un diagramma di fase
Un diagramma di fase è una semplice mappa che mostra lo stato di una sostanza (solido, liquido o gas) a qualsiasi combinazione di temperatura e pressione.
Il confine liquido-gas
La linea che separa le fasi liquida e gassosa è sempre inclinata verso l'alto e verso destra. Ciò conferma visivamente che aumentando la pressione (spostandosi verso l'alto sull'asse verticale), è necessario aumentare anche la temperatura (spostandosi verso destra sull'asse orizzontale) per far bollire la sostanza.
Il confine solido-liquido
La linea tra le fasi solida e liquida è quasi verticale, mostrando che la pressione ha un'influenza molto minore sulla fusione.
Per la maggior parte delle sostanze, questa linea è leggermente inclinata verso destra (maggiore pressione, maggiore punto di fusione). Per l'acqua, questa linea è unicamente inclinata verso sinistra, mostrando che una pressione maggiore porta a un punto di fusione inferiore.
Principi chiave per l'applicazione pratica
Per applicare efficacemente questa conoscenza, concentrati sulla sostanza e sul tipo di cambiamento di fase coinvolto.
- Se hai a che fare con l'ebollizione o la condensazione: Ricorda che la pressione è il fattore dominante. Maggiore pressione significa punto di ebollizione più alto e minore pressione significa punto di ebollizione più basso.
- Se hai a che fare con la fusione o il congelamento (per la maggior parte dei materiali): L'effetto della pressione è minore. Una pressione più elevata aumenterà leggermente il punto di fusione favorendo lo stato solido più denso.
- Se hai a che fare specificamente con il ghiaccio d'acqua: Ricorda che è l'eccezione. Una pressione più elevata abbassa il punto di congelamento/fusione favorendo lo stato liquido più denso.
Comprendere come interagiscono pressione e temperatura ti dà il controllo diretto sullo stato fisico della materia.
Tabella riassuntiva:
| Cambiamento di fase | Effetto dell'aumento della pressione | Principio chiave | Esempio comune |
|---|---|---|---|
| Ebollizione | Aumenta il punto di ebollizione | Favorisce la fase più densa (liquida) | Pentola a pressione (l'acqua bolle a >100°C) |
| Fusione (La maggior parte dei materiali) | Aumenta leggermente il punto di fusione | Favorisce la fase solida più densa | Metalli sotto alta pressione |
| Fusione (Acqua/Ghiaccio) | Abbassa il punto di fusione | Favorisce la fase liquida più densa | Pattinaggio su ghiaccio (la pressione scioglie il ghiaccio) |
Hai bisogno di un controllo preciso dei cambiamenti di fase nei tuoi processi di laboratorio? KINTEK è specializzata in apparecchiature ad alta pressione e temperatura per applicazioni di laboratorio. Sia che tu stia sviluppando nuovi materiali, conducendo sintesi chimiche o studiando il comportamento di fase, i nostri reattori e forni forniscono l'esatto controllo di pressione e temperatura di cui hai bisogno. Contatta oggi i nostri esperti per discutere come le nostre soluzioni possono migliorare l'efficienza e l'accuratezza della tua ricerca.
Guida Visiva
Prodotti correlati
- Reattori personalizzabili ad alta pressione per applicazioni scientifiche e industriali avanzate
- Mini reattore autoclave ad alta pressione in SS per uso di laboratorio
- Reattore Autoclave da Laboratorio ad Alta Pressione per Sintesi Idrotermale
- Reattore Autoclave di Laboratorio ad Alta Pressione in Acciaio Inossidabile
- Fornace a tubo sottovuoto ad alta pressione da laboratorio
Domande frequenti
- Quanto costa la biomassa rispetto ad altre fonti energetiche? Una guida ai costi, ai compromessi e al valore
- Qual è il sistema di trasferimento del calore più efficiente? Ottimizza le prestazioni per la tua applicazione
- Qual è il significato dell'uso di una valvola a spillo per iniettare ossigeno puro? Controllo preciso dei processi di lisciviazione ossidativa
- Perché un forno di essiccazione sotto vuoto è preferito a un forno di calcinazione ad alta temperatura per il trattamento termico post-sintesi di nanopolveri di ossido di zinco (ZnO)?
- Qual è la differenza tra forno da laboratorio (oven) e fornace da laboratorio (furnace)? Scegli lo strumento termico giusto per il tuo laboratorio
- Cos'è la deposizione a sputtering d'oro per SEM? Prevenire la carica e migliorare la qualità dell'immagine per campioni non conduttivi
- Quali sono le diverse tecniche di conversione della biomassa? Abbina la materia prima al prodotto finale per la bioenergia ottimale
- Cos'è la sinterizzazione naturale? Scopri il processo geologico che forma i giacimenti minerari



















