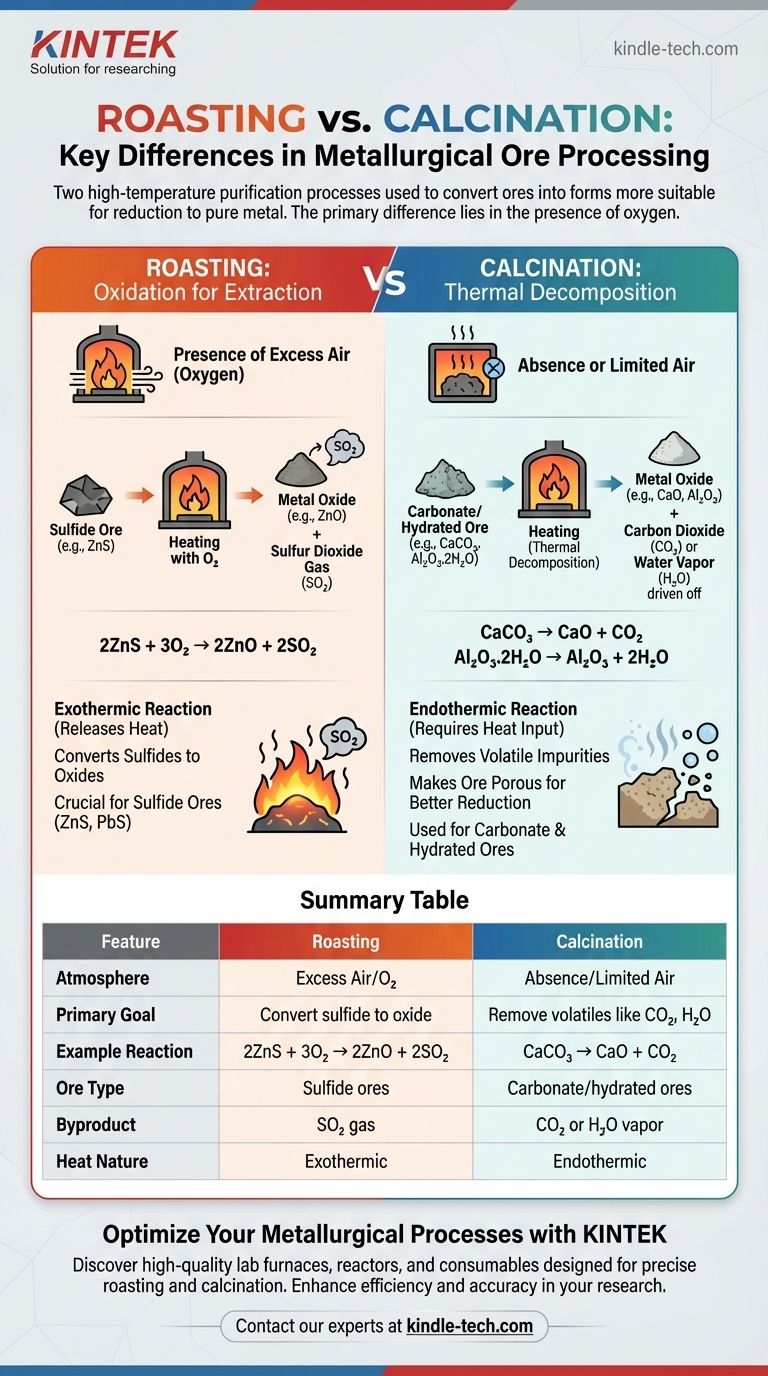
In sostanza, la differenza principale tra arrostimento e calcinazione risiede nella presenza di ossigeno. L'arrostimento è il processo di riscaldamento di un minerale concentrato a una temperatura elevata in presenza di un eccesso di aria. Al contrario, la calcinazione comporta il riscaldamento di un minerale a una temperatura elevata o in assenza di aria o con una fornitura molto limitata. Entrambi sono passaggi preliminari cruciali in metallurgia, progettati per convertire i minerali in una forma più adatta alla riduzione al metallo puro.
Sebbene entrambi siano processi di purificazione ad alta temperatura, l'arrostimento utilizza l'ossigeno per convertire chimicamente i minerali solfuri in ossidi. La calcinazione, d'altra parte, utilizza il calore da solo per decomporre termicamente i minerali carbonati o idrati, eliminando sostanze volatili come l'anidride carbonica e l'acqua.

Comprendere l'Arrostimento: Ossidazione per l'Estrazione
L'arrostimento è un processo pirometallurgico chiave, il che significa che utilizza il calore per indurre cambiamenti chimici nel minerale. La sua applicazione principale è per i minerali solfuri.
L'Obiettivo Fondamentale
Lo scopo principale dell'arrostimento è convertire un solfuro metallico in un ossido metallico. Gli ossidi metallici sono significativamente più facili ed economicamente più vantaggiosi da ridurre a metallo puro rispetto ai loro omologhi solfuri.
La Reazione Chimica e l'Esempio
Durante l'arrostimento, il minerale reagisce con l'ossigeno presente nell'aria. Questo converte il solfuro metallico in un ossido metallico e produce anidride solforosa (SO₂) come sottoprodotto.
Un esempio classico è l'arrostimento della sfalerite (ZnS) per produrre ossido di zinco (ZnO), una fase cruciale nell'estrazione dello zinco:
2ZnS + 3O₂ → 2ZnO + 2SO₂
Caratteristiche Chiave dell'Arrostimento
Questo processo viene eseguito in un forno specializzato, come un forno riverberante o a flash, a una temperatura inferiore al punto di fusione del minerale. Per molti minerali solfuri, la reazione è esotermica, il che significa che rilascia calore e può auto-sostenersi una volta avviata.
Comprendere la Calcinazione: Decomposizione Termica
La calcinazione è un altro processo di trattamento termico, ma il suo meccanismo chimico è completamente diverso. Viene utilizzata principalmente per minerali carbonati e idrati.
L'Obiettivo Fondamentale
L'obiettivo della calcinazione è rimuovere le impurità volatili riscaldando il minerale. Questo elimina sostanze come l'anidride carbonica (dai carbonati) o l'acqua (dagli ossidi idrati), lasciando dietro di sé un ossido metallico più concentrato.
La Reazione Chimica e l'Esempio
La calcinazione è una reazione di decomposizione termica che avviene in assenza di aria. Un esempio principale è la calcinazione del calcare (carbonato di calcio, CaCO₃) per produrre calce (ossido di calcio, CaO):
CaCO₃ → CaO + CO₂
Un altro uso comune è per i minerali idrati, come la bauxite (ossido di alluminio idrato), per rimuovere l'acqua prima del processo di estrazione dell'alluminio:
Al₂O₃.2H₂O → Al₂O₃ + 2H₂O
Caratteristiche Chiave della Calcinazione
Questo processo è endotermico, richiedendo un apporto continuo di calore. Rende il minerale poroso, il che aumenta la superficie disponibile per la successiva fase di riduzione, aumentandone così l'efficienza.
Comprendere i Compromessi e il Contesto
La scelta tra questi processi non è una questione di preferenza; è dettata dalla chimica del minerale. Capire il perché è fondamentale per comprendere la metallurgia.
Perché non ridurre direttamente i solfuri?
Ridurre direttamente i solfuri metallici a metallo è termodinamicamente difficile e costoso. Convertirli prima in ossidi fornisce un percorso molto più efficiente ed economico per la riduzione, utilizzando tipicamente il carbonio (coke) come agente riducente.
Gestione dei Sottoprodotti
L'arrostimento produce anidride solforosa (SO₂), un gas che può causare piogge acide se rilasciato nell'atmosfera. Gli impianti metallurgici moderni catturano questo gas e lo utilizzano per produrre acido solforico, trasformando un potenziale rischio ambientale in un prezioso prodotto commerciale.
L'Importanza di un Minerale Poroso
La capacità della calcinazione di creare un minerale poroso e friabile è un vantaggio significativo. Questa maggiore superficie consente all'agente riducente (come il monossido di carbonio in un altoforno) di interagire più efficacemente con l'ossido metallico, accelerando l'estrazione finale del metallo.
Fare la Scelta Giusta per il Tuo Minerale
La scelta tra arrostimento e calcinazione è dettata interamente dalla composizione chimica del minerale che devi lavorare.
- Se il tuo minerale è un solfuro (come sfalerite, ZnS, o galena, PbS): Devi usare l'arrostimento per convertire il solfuro in un ossido prima che possa essere ridotto al metallo puro.
- Se il tuo minerale è un carbonato (come calamina, ZnCO₃, o calcare, CaCO₃): Devi usare la calcinazione per decomporlo termicamente ed eliminare l'anidride carbonica, ottenendo l'ossido metallico.
- Se il tuo minerale è un ossido idrato (come la bauxite, Al₂O₃.2H₂O): Devi usare la calcinazione per rimuovere l'acqua chimicamente legata e produrre un ossido anidro puro.
Comprendere questa distinzione fondamentale è il primo passo per progettare un processo di estrazione metallurgica efficace ed efficiente.
Tabella Riassuntiva:
| Caratteristica | Arrostimento | Calcinazione |
|---|---|---|
| Atmosfera | Eccesso di aria (presenza di O₂) | Assenza o aria limitata |
| Obiettivo Primario | Convertire i minerali solfuri in ossidi | Rimuovere le impurità volatili (CO₂, H₂O) |
| Reazione Esempio | 2ZnS + 3O₂ → 2ZnO + 2SO₂ | CaCO₃ → CaO + CO₂ |
| Tipo di Minerale | Minerali solfuri (es. ZnS, PbS) | Minerali carbonati/idrati (es. CaCO₃, bauxite) |
| Sottoprodotto | Gas SO₂ | Vapore di CO₂ o H₂O |
| Natura del Calore | Esotermico (rilascia calore) | Endotermico (richiede apporto di calore) |
Ottimizza i Tuoi Processi Metallurgici con KINTEK
Sia che tu stia lavorando minerali solfuri tramite arrostimento o decomponendo carbonati tramite calcinazione, disporre delle giuste attrezzature da laboratorio è fondamentale per l'efficienza e l'accuratezza. KINTEK è specializzata nella fornitura di forni da laboratorio, reattori e materiali di consumo di alta qualità progettati per soddisfare le rigorose esigenze dei test e della ricerca metallurgica.
I nostri prodotti garantiscono un controllo preciso della temperatura, un riscaldamento uniforme e una lunga durata, fattori chiave per il successo delle operazioni di arrostimento e calcinazione. Collaborando con KINTEK, avrai accesso a:
- Attrezzature affidabili che migliorano la riproducibilità del processo
- Supporto esperto per aiutarti a selezionare gli strumenti giusti per il tuo tipo specifico di minerale
- Soluzioni che migliorano la sicurezza e la conformità ambientale
Pronto a perfezionare il tuo processo di estrazione? Contatta oggi i nostri esperti per discutere di come le apparecchiature da laboratorio di KINTEK possono supportare le tue innovazioni metallurgiche e portare avanti la tua ricerca.
Guida Visiva
Prodotti correlati
- Fornace a Tubo al Quarzo per Trattamento Termico Rapido (RTP) da Laboratorio
- Fornace a Tubo da Laboratorio ad Alta Temperatura da 1700℃ con Tubo di Allumina
- Fornace di Grafittizzazione per Film ad Alta Conducibilità Termica al Vuoto di Grafite
- Fornace a muffola da 1700℃ per laboratorio
- Fornace per Trattamento Termico Sottovuoto con Rivestimento in Fibra Ceramica
Domande frequenti
- Qual è la funzione dei tubi di quarzo e dei sistemi di sigillatura sottovuoto? Assicura la sintesi della tua soluzione solida ad alta purezza
- Qual è il valore tecnico dell'utilizzo di una camera di reazione a tubo di quarzo per test di corrosione statici? Ottenere Precisione.
- Come fa un forno tubolare industriale a garantire le condizioni di processo richieste per i dispositivi sperimentali a fluido supercritico?
- Qual è il ruolo di un forno tubolare nel trattamento termico degli elettroliti argyrodite? Padroneggiare la conducibilità ionica
- Quali sono le funzioni primarie dei forni tubolari ad alta precisione nella crescita del grafene? Ottenere la sintesi di GS priva di difetti



















