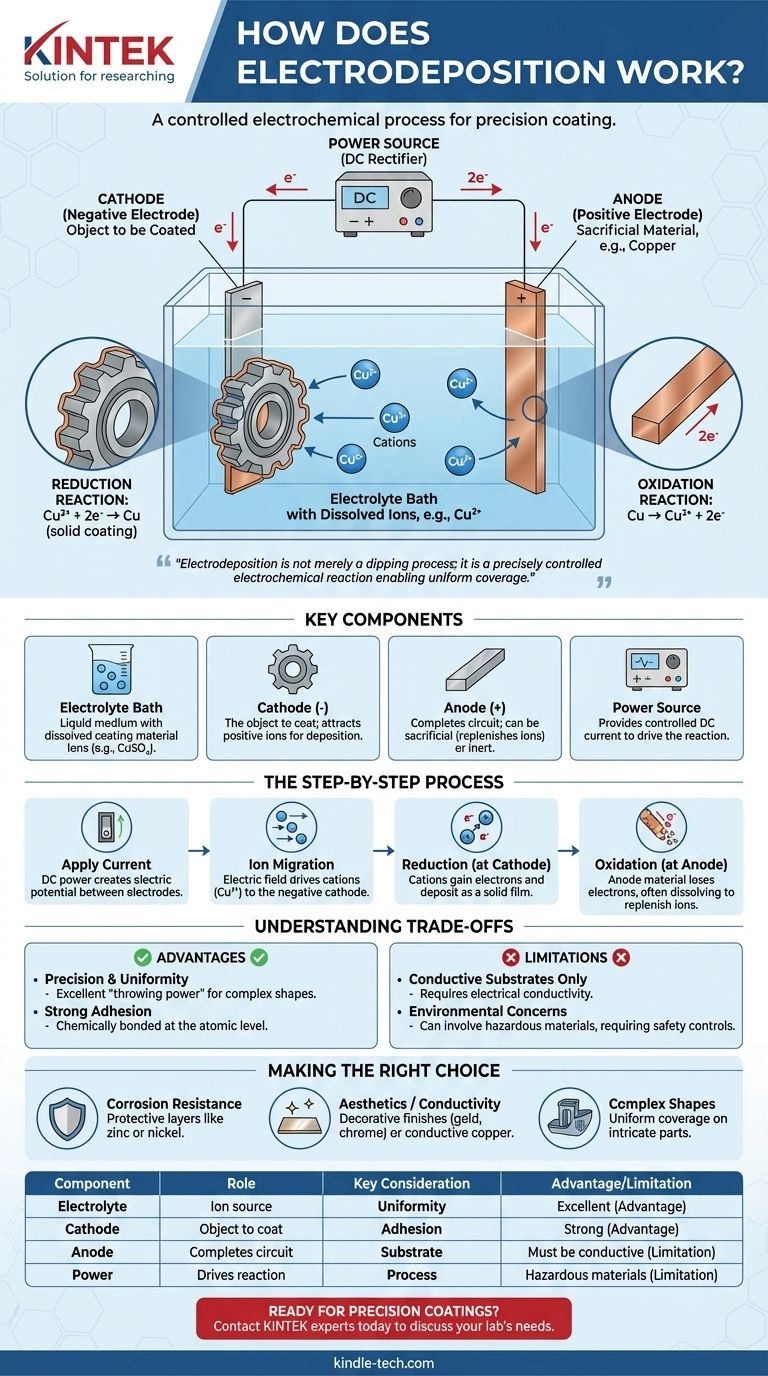
In sintesi, l'elettrodeposizione è un processo che utilizza una corrente elettrica per rivestire un oggetto conduttivo con un sottile strato di materiale. Ciò si ottiene immergendo l'oggetto (il catodo) e un secondo elettrodo (l'anodo) in una soluzione chimica, o bagno elettrolitico, contenente ioni disciolti del materiale di rivestimento. Quando viene applicata una corrente continua, questi ioni vengono attratti verso la superficie dell'oggetto, dove vengono "depositati" come un solido, creando un film metallico o organico uniforme e aderente.
L'intuizione cruciale è che l'elettrodeposizione non è semplicemente un processo di immersione; è una reazione elettrochimica precisamente controllata. Il campo elettrico detta dove e come si forma il rivestimento, consentendo la copertura uniforme anche delle forme più complesse con uno strato il cui spessore è direttamente proporzionale alla corrente e al tempo applicati.

I componenti chiave della cella di elettrodeposizione
Per comprendere il processo, è necessario prima comprenderne i componenti fondamentali. Ogni configurazione di elettrodeposizione, da un becher da laboratorio a un serbatoio industriale, è costituita da quattro parti essenziali che lavorano in concerto.
Il bagno elettrolitico
L'elettrolita è il mezzo liquido che facilita l'intero processo. È una soluzione, tipicamente a base acquosa, contenente sali disciolti del materiale da depositare. Ad esempio, nella ramatura, il bagno conterrebbe un sale come il solfato di rame (CuSO₄), che fornisce gli ioni di rame (Cu²⁺).
Il catodo (elettrodo negativo)
Questo è l'oggetto che si intende rivestire. È collegato al terminale negativo dell'alimentatore. La carica negativa sulla sua superficie è ciò che attrae gli ioni metallici caricati positivamente dal bagno elettrolitico.
L'anodo (elettrodo positivo)
Collegato al terminale positivo dell'alimentatore, l'anodo completa il circuito elettrico. Gli anodi possono essere "sacrificali", fatti dello stesso materiale del rivestimento, che si dissolvono per reintegrare gli ioni nel bagno, o "inerti", fatti di un materiale non reattivo come il platino o il carbonio.
La fonte di alimentazione
Un alimentatore a corrente continua (DC), come un raddrizzatore, fornisce l'energia elettrica necessaria per guidare la reazione. La tensione e la corrente sono attentamente controllate per gestire la velocità e la qualità della deposizione.
Il processo elettrochimico passo-passo
Con i componenti in posizione, il processo si svolge come una sequenza controllata di eventi elettrochimici.
Applicazione della corrente
Nel momento in cui viene attivata l'alimentazione CC, viene stabilito un potenziale elettrico tra l'anodo e il catodo. Questo crea un campo elettrico in tutto il bagno elettrolitico.
Migrazione ionica
Spinte da questo campo elettrico, le particelle cariche (ioni) nella soluzione iniziano a muoversi. Gli ioni caricati positivamente, noti come cationi (ad esempio, Cu²⁺), sono attratti dal catodo caricato negativamente (il pezzo in lavorazione).
La reazione di riduzione al catodo
Questo è il cuore del processo di rivestimento. Quando i cationi raggiungono la superficie del catodo, acquisiscono elettroni. Questo processo chimico è chiamato riduzione. L'acquisizione di elettroni neutralizza la loro carica, facendoli depositare sulla superficie come un film metallico solido.
Per il rame, la reazione è: Cu²⁺ (in soluzione) + 2e⁻ → Cu (rivestimento solido)
La reazione di ossidazione all'anodo
Contemporaneamente, una corrispondente reazione chiamata ossidazione si verifica all'anodo, dove una sostanza perde elettroni. Se viene utilizzato un anodo sacrificale, questo si dissolve lentamente nel bagno, reintegrando gli ioni metallici che sono stati depositati sul catodo e garantendo un processo stabile.
La reazione dell'anodo di rame sacrificale è: Cu (anodo solido) → Cu²⁺ (in soluzione) + 2e⁻
Comprendere i compromessi
Sebbene potente, l'elettrodeposizione non è una soluzione universale. Comprendere i suoi vantaggi e limiti è fondamentale per la sua corretta applicazione.
Vantaggio: precisione e uniformità
La forza primaria dell'elettrodeposizione è la sua capacità di creare rivestimenti altamente uniformi, anche su oggetti con geometrie complesse, fori e superfici interne. Questa "potenza di penetrazione" è difficile da ottenere con metodi a vista come la verniciatura a spruzzo.
Vantaggio: forte adesione
Poiché il rivestimento è formato attraverso un legame elettrochimico a livello atomico, l'adesione tra il substrato e lo strato depositato è eccezionalmente forte e durevole.
Limitazione: solo substrati conduttivi
Il processo si basa fondamentalmente sulla capacità del pezzo in lavorazione di condurre elettricità. Materiali non conduttivi come plastiche o ceramiche non possono essere rivestiti direttamente senza essere prima trattati con uno strato conduttivo.
Limitazione: preoccupazioni ambientali e di sicurezza
Molti bagni elettrolitici industriali contengono materiali pericolosi, come acidi forti, metalli pesanti o cianuri. Ciò richiede rigorosi controlli di processo, trattamenti speciali dei rifiuti e robusti protocolli di sicurezza per proteggere i lavoratori e l'ambiente.
Fare la scelta giusta per il tuo obiettivo
La decisione di utilizzare l'elettrodeposizione dipende dal tuo specifico obiettivo tecnico.
- Se il tuo obiettivo principale è la resistenza alla corrosione: l'elettrodeposizione è una scelta eccellente per applicare strati protettivi come zinco (zincatura) o nichel, che creano una barriera densa e non porosa contro gli elementi.
- Se il tuo obiettivo principale è l'estetica o la conducibilità: il processo è ideale per finiture decorative come cromo, oro e argento, o per l'applicazione di strati altamente conduttivi di rame nella produzione elettronica.
- Se il tuo obiettivo principale è il rivestimento di forme complesse e intricate: la capacità dell'elettrodeposizione di coprire uniformemente tutte le superfici bagnate la rende superiore a quasi tutti gli altri metodi per parti con caratteristiche interne o esterne complesse.
Padroneggiando l'interazione tra chimica ed elettricità, l'elettrodeposizione offre un controllo senza pari per progettare una superficie per soddisfare una specifica esigenza.
Tabella riassuntiva:
| Componente | Ruolo nell'elettrodeposizione |
|---|---|
| Bagno elettrolitico | Soluzione contenente ioni disciolti del materiale di rivestimento. |
| Catodo | L'oggetto da rivestire; attrae ioni positivi. |
| Anodo | Completa il circuito; può essere sacrificale o inerte. |
| Fonte di alimentazione | Fornisce la corrente continua (DC) per guidare la reazione. |
| Considerazione chiave | Vantaggio / Limitazione |
|---|---|
| Uniformità del rivestimento | Eccellente per forme complesse (Vantaggio) |
| Adesione | Legame forte, a livello atomico (Vantaggio) |
| Substrato | Richiede una superficie conduttiva (Limitazione) |
| Processo | Coinvolge materiali pericolosi (Limitazione) |
Pronto a ottenere rivestimenti di precisione nel tuo laboratorio?
Il processo controllato di elettrodeposizione è essenziale per applicazioni che richiedono strati metallici uniformi, dalla protezione dalla corrosione alla conducibilità elettronica. KINTEK è specializzata nella fornitura di attrezzature da laboratorio e materiali di consumo affidabili di cui hai bisogno per perfezionare i tuoi processi di elettrodeposizione in modo sicuro ed efficiente.
Contatta i nostri esperti oggi per discutere come le nostre soluzioni possono migliorare le capacità del tuo laboratorio e aiutarti a raggiungere i tuoi specifici obiettivi di rivestimento.
Guida Visiva
Prodotti correlati
- Apparecchiatura per macchine HFCVD per rivestimento di nano-diamante per matrici di trafilatura
- 915MHz MPCVD Diamond Machine Sistema di deposizione chimica da vapore al plasma a microonde Reattore
- Vagli da Laboratorio e Setacciatrici
- Puntali per utensili da taglio in diamante CVD per lavorazioni di precisione
- Elettrodo a disco rotante (anello-disco) RRDE / compatibile con PINE, ALS giapponese, Metrohm svizzero al carbonio vetroso platino
Domande frequenti
- Cos'è la CVD al plasma a microonde? Una guida alla sintesi di diamanti e materiali ad alta purezza
- Come migliorano le apparecchiature PACVD i rivestimenti DLC? Sblocca bassa frizione e alta resistenza al calore
- Come vengono introdotti i reagenti nella camera di reazione durante un processo CVD? Padroneggiare i sistemi di erogazione dei precursori
- Qual è il ruolo del sistema HF-CVD nella preparazione degli elettrodi BDD? Soluzioni scalabili per la produzione di diamanti drogati con boro
- Qual è la funzione specifica del filamento metallico nella HF-CVD? Ruoli chiave nella crescita del diamante



















