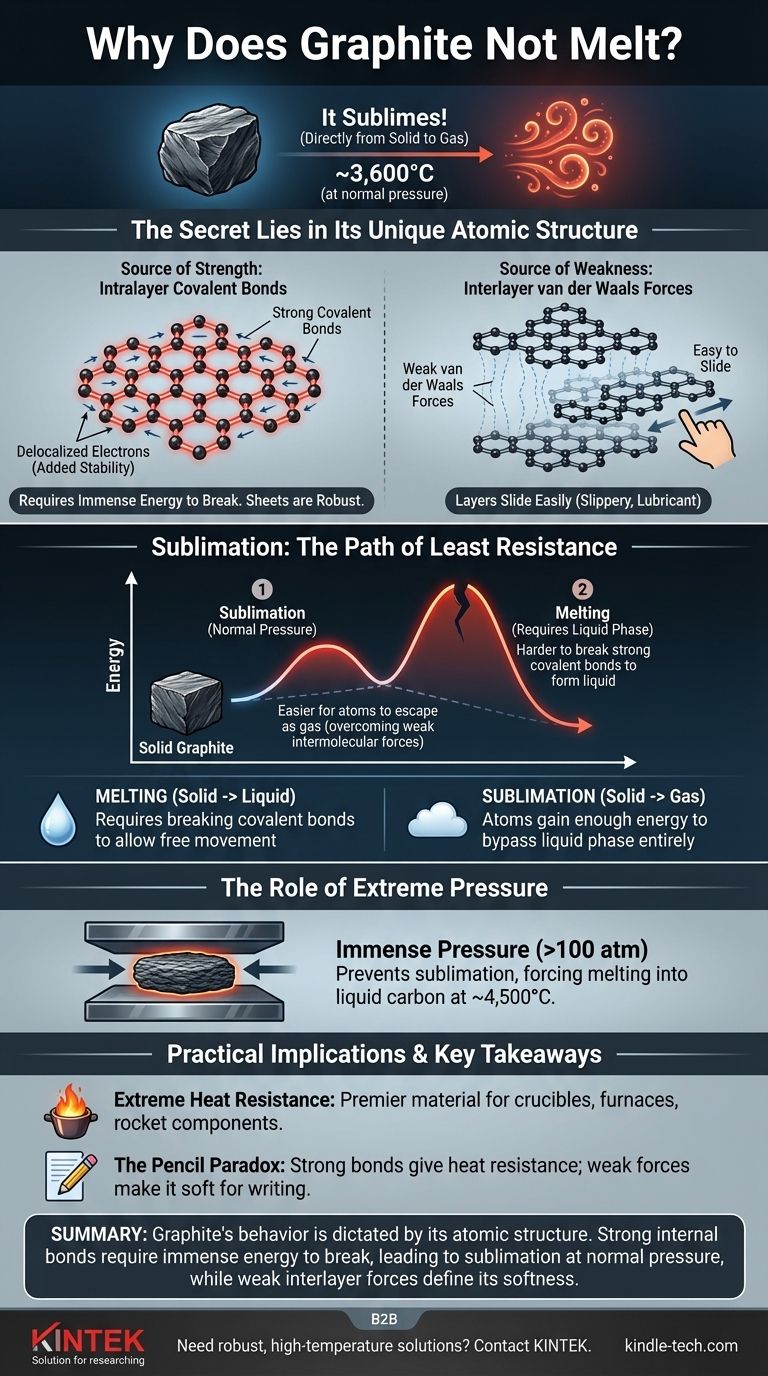
È un errore comune pensare che la grafite non fonda. Sotto normale pressione atmosferica, la grafite fa qualcosa di diverso: sublima, trasformandosi direttamente da solido a gas a una temperatura incredibilmente alta di circa 3.600°C (6.500°F). Questo comportamento è il risultato diretto dell'immensa forza dei legami chimici che tengono uniti i suoi atomi di carbonio.
La ragione principale dell'estrema resistenza al calore della grafite è la sua struttura atomica unica. È costituita da strati di atomi di carbonio uniti da legami covalenti eccezionalmente forti, che richiedono un'enorme quantità di energia per essere rotti e permettere alla sostanza di cambiare stato.

Decostruire la Struttura Atomica della Grafite
Per capire perché la grafite si comporta in questo modo, dobbiamo osservare come sono disposti i suoi atomi di carbonio. La sua struttura è definita da due tipi molto diversi di legami chimici che operano contemporaneamente.
La Fonte di Forza: Legami Covalenti all'Interno degli Strati
La grafite è composta da fogli piatti e bidimensionali di atomi di carbonio disposti in un reticolo esagonale, a nido d'ape.
All'interno di ogni foglio, ogni atomo di carbonio è collegato ad altri tre tramite forti legami covalenti. Questi sono tra i legami chimici più potenti in natura.
Inoltre, un elettrone di ogni atomo di carbonio diventa delocalizzato, il che significa che è libero di muoversi attraverso l'intero foglio. Questa condivisione di elettroni tra tutti gli atomi nello strato aggiunge una significativa stabilità e rafforza ulteriormente i legami, rendendo i fogli incredibilmente robusti e difficili da rompere.
La Fonte di Debolezza: Forze Tra gli Strati
Mentre gli atomi all'interno di uno strato sono legati potentemente, gli strati stessi sono tenuti insieme da forze molto più deboli note come forze di van der Waals.
Queste forze sono abbastanza deboli da permettere agli strati di scivolare facilmente l'uno sull'altro. Questo è il motivo per cui la grafite è scivolosa e viene usata come lubrificante e nelle matite: la scrittura lascia dietro di sé strati di grafite sulla carta.
Sublimazione: Il Percorso di Minore Resistenza
L'estrema differenza tra i forti legami all'interno degli strati e le deboli forze tra di essi determina come la grafite risponde al calore.
Fusione vs. Sublimazione
La fusione è il processo in cui un solido si trasforma in un liquido. Affinché ciò avvenga, gli atomi devono acquisire energia sufficiente per liberarsi dalle loro posizioni fisse ma rimanere comunque attratti l'uno dall'altro.
La sublimazione è la transizione diretta da un solido a un gas. In questo caso, gli atomi acquisiscono così tanta energia da bypassare completamente la fase liquida e sfuggire nell'aria.
Perché la Sublimazione Vince a Pressione Normale
A pressione atmosferica standard, l'energia necessaria per rompere i potenti legami covalenti all'interno degli strati di grafite è immensa.
Prima che la struttura possa assorbire energia sufficiente per fondere in un liquido, gli atomi sulla superficie acquisiscono energia sufficiente per superare le deboli forze intermolecolari e semplicemente volare via come gas. È energeticamente più facile per gli atomi sfuggire direttamente allo stato gassoso piuttosto che rompere i legami covalenti necessari per formare un liquido.
Il Ruolo della Pressione Estrema
La grafite può essere costretta a fondere, ma solo in condizioni straordinarie.
Applicando un'immensa pressione (oltre 100 volte la normale pressione atmosferica), si può impedire agli atomi di carbonio di sfuggire come gas. In queste condizioni, la grafite fonderà in carbonio liquido a una temperatura di circa 4.500°C (8.132°F).
Le Implicazioni Pratiche di Questa Struttura
Questa unica struttura a doppio legame conferisce alla grafite un insieme di proprietà che sembrano contraddittorie ma sono essenziali per le sue applicazioni industriali.
Estrema Resistenza al Calore
L'alto punto di sublimazione rende la grafite un materiale di prim'ordine per ambienti ad alta temperatura. Viene utilizzata per realizzare crogioli per la fusione dei metalli, rivestimenti per forni e componenti di motori a razzo che devono resistere a un calore enorme.
Il Paradosso della Matita
La struttura della grafite spiega come possa essere sia incredibilmente resistente al calore che sorprendentemente morbida. La forza deriva dai legami covalenti all'interno degli strati, mentre la morbidezza e le proprietà lubrificanti derivano dalla facilità con cui questi strati scorrono l'uno sull'altro.
Punti Chiave per Comprendere la Grafite
- Se il tuo focus principale è il suo comportamento al calore: Ricorda che a pressione normale, la grafite sublima direttamente a gas perché l'energia necessaria per farlo è inferiore all'energia richiesta per rompere i legami covalenti e formare un liquido.
- Se il tuo focus principale sono le sue proprietà fisiche: La chiave è la sua struttura a strati. I legami forti all'interno degli strati forniscono resistenza al calore, mentre le forze deboli tra gli strati la rendono morbida e un efficace lubrificante.
- Se il tuo focus principale è la definizione tecnica di fusione: La grafite può assolutamente fondere, ma solo sotto pressione estremamente elevata che impedisce agli atomi di sublimare prima.
In definitiva, il comportamento della grafite è un'illustrazione perfetta di come la struttura atomica di un materiale ne determini le proprietà nel mondo reale.
Tabella Riepilogativa:
| Proprietà | Descrizione | Motivo Principale |
|---|---|---|
| Punto di Sublimazione | ~3.600°C (a pressione normale) | Le deboli forze di van der Waals tra gli strati permettono agli atomi di sfuggire come gas prima della fusione. |
| Punto di Fusione | ~4.500°C (sotto pressione estrema >100 atm) | L'alta pressione impedisce la sublimazione, costringendo i legami covalenti a rompersi per la fusione. |
| Resistenza al Calore | Eccellente per applicazioni ad alta temperatura | I legami covalenti estremamente forti all'interno degli strati di carbonio richiedono un'immensa energia per rompersi. |
Hai bisogno di soluzioni robuste e ad alta temperatura per il tuo laboratorio?
Le proprietà uniche della grafite la rendono un materiale essenziale per applicazioni esigenti. Noi di KINTEK siamo specializzati nella fornitura di attrezzature e materiali di consumo da laboratorio di alta qualità, inclusi crogioli in grafite e componenti per forni, progettati per resistere a condizioni estreme.
Lascia che i nostri esperti ti aiutino a selezionare i materiali giusti per migliorare l'efficienza e la sicurezza del tuo laboratorio. Contatta KINTEK oggi stesso per discutere le tue specifiche esigenze di alta temperatura!
Guida Visiva
Prodotti correlati
- Fornace di grafitazione sottovuoto verticale ad alta temperatura
- Fornace di grafitazione sottovuoto a temperatura ultra-elevata in grafite
- Fornace di Grafittizzazione per Film ad Alta Conducibilità Termica al Vuoto di Grafite
- Fornace di Grafittizzazione Continua Sottovuoto di Grafite
- Fornace a tubo da laboratorio ad alta temperatura da 1400℃ con tubo in allumina
Domande frequenti
- Quali sono i vantaggi dell'utilizzo di apparecchiature a riscaldamento Joule estremamente rapido (EJH)? Precisione nella sintesi di film sottili
- Quali sono le caratteristiche della sinterizzazione? Porosità Controllata e Materiali ad Alte Prestazioni
- Quali sono i pericoli del riscaldamento in laboratorio? Protocolli di sicurezza essenziali per prevenire ustioni, incendi ed esplosioni
- Qual è la definizione di sinterizzazione? Produzione termica di precisione per solidi ad alta densità
- Qual è la regola Delta 20 per l'evaporazione? Padroneggiare irrorazioni sicure ed efficaci
- Quanta elettricità consuma un forno ad arco? L'immensa potenza dietro la moderna produzione di acciaio
- Quali sono i vantaggi del titanio nell'aviazione? Sblocca aerei più leggeri, più robusti e più sicuri
- Cos'è la tecnica di sputtering per la deposizione di film sottili? Ottieni rivestimenti superiori con versatilità dei materiali



















