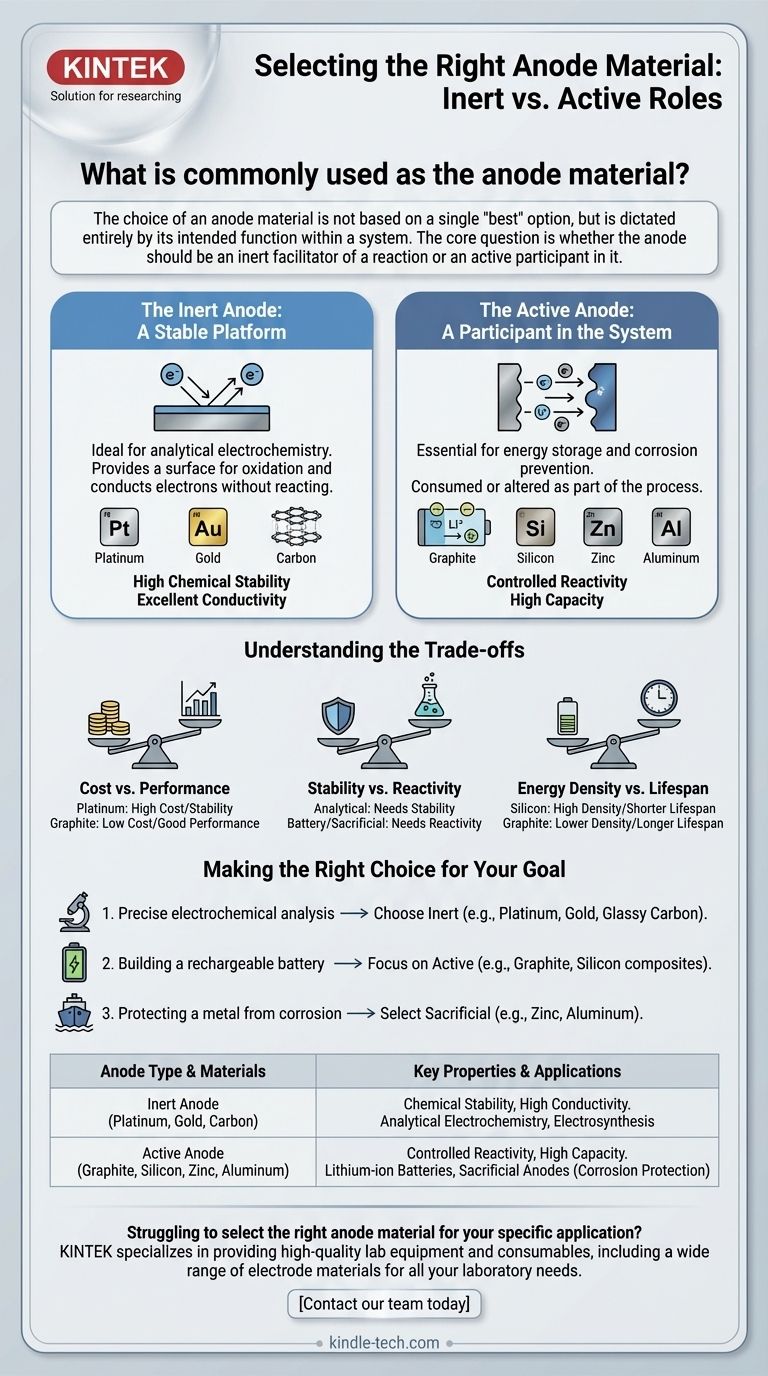
In molti contesti di laboratorio, i materiali anodici più comunemente utilizzati sono il platino, l'oro e il carbonio (spesso sotto forma di grafite o carbonio vetroso). Questi materiali sono scelti per la loro inerzia chimica e conduttività elettrica, assicurando che facilitino una reazione senza interferire con essa. Tuttavia, questo è solo un pezzo di un quadro molto più ampio.
La scelta di un materiale anodico non si basa su una singola opzione "migliore", ma è dettata interamente dalla sua funzione prevista all'interno di un sistema. La domanda fondamentale è se l'anodo debba essere un facilitatore inerte di una reazione o un partecipante attivo in essa.

I Due Ruoli Fondamentali di un Anodo
Il termine "anodo" si riferisce semplicemente all'elettrodo dove avviene l'ossidazione (la perdita di elettroni). Il materiale ideale per questo ruolo cambia drasticamente a seconda dell'obiettivo dell'applicazione. Possiamo separare queste applicazioni in due categorie principali: quelle che richiedono un anodo inerte e quelle che ne richiedono uno attivo.
L'Anodo Inerte: Una Piattaforma Stabile
In applicazioni come l'elettrochimica analitica, un anodo inerte è essenziale. Il suo unico compito è fornire una superficie affinché avvenga l'ossidazione e condurre gli elettroni fuori dal sistema.
Il materiale stesso non dovrebbe cambiare o reagire. Ciò assicura che le misurazioni effettuate riflettano la chimica della soluzione, non il degrado dell'elettrodo.
Questo è il motivo per cui materiali come platino, oro e carbonio sono scelte standard. Possiedono le proprietà critiche di elevata conduttività ed eccezionale stabilità chimica in un ampio intervallo di condizioni.
L'Anodo Attivo: Un Partecipante nel Sistema
In molte altre tecnologie critiche, l'anodo è progettato per essere un partecipante attivo ed essenziale nel processo chimico. Qui, il materiale viene consumato o alterato come parte della funzione del sistema.
Questo è più comune nello stoccaggio di energia e nella prevenzione della corrosione. Il materiale viene scelto specificamente per le sue proprietà reattive.
Un esempio lampante è una batteria agli ioni di litio, dove l'anodo è tipicamente in grafite. Il compito della grafite è assorbire e rilasciare ioni di litio durante la carica e la scarica. La sua reattività chimica è la sua caratteristica principale.
Un altro esempio chiave è nella prevenzione della corrosione, dove un anodo sacrificale fatto di zinco, alluminio o magnesio è fissato a una struttura in acciaio come lo scafo di una nave. Lo zinco, più reattivo, si corrode (ossida) per primo, sacrificandosi per proteggere l'acciaio.
Comprendere i Compromessi
La selezione di un materiale anodico comporta sempre il bilanciamento di fattori in competizione. Non esiste un singolo materiale perfetto per ogni situazione.
Costo vs. Prestazioni
Il platino offre una stabilità e proprietà catalitiche eccezionali, ma è estremamente costoso. La grafite e altre forme di carbonio offrono eccellenti prestazioni per molte applicazioni a una frazione del costo, rendendoli onnipresenti nei prodotti commerciali.
Stabilità vs. Reattività
Questo è il compromesso centrale. Per una misurazione analitica, è necessaria la massima stabilità in modo che l'anodo non interferisca. Per una batteria o un sistema sacrificale, è necessaria una reattività precisamente controllata affinché il dispositivo funzioni.
Densità Energetica vs. Durata
Nella tecnologia delle batterie, questa è una sfida critica. Il silicio è oggetto di intense ricerche come materiale anodico di prossima generazione perché può immagazzinare molti più ioni di litio rispetto alla grafite. Tuttavia, si gonfia e si restringe fisicamente in modo significativo durante la carica e la scarica, il che può causarne il rapido degrado e il cedimento.
Fare la Scelta Giusta per il Tuo Obiettivo
L'anodo giusto è quello che serve allo scopo specifico del tuo sistema elettrochimico. Il tuo obiettivo principale restringerà immediatamente le opzioni.
- Se il tuo obiettivo principale è l'analisi elettrochimica precisa: Scegli un materiale inerte come platino, oro o carbonio vetroso per garantire che le tue misurazioni non siano influenzate dall'elettrodo stesso.
- Se il tuo obiettivo principale è costruire una batteria ricaricabile: Concentrati su materiali attivi con elevata capacità e stabilità di ciclo, come la grafite o materiali emergenti come i compositi di silicio.
- Se il tuo obiettivo principale è proteggere un metallo dalla corrosione: Seleziona un materiale sacrificale che sia elettrochimicamente più attivo del metallo che stai proteggendo, come zinco o alluminio per l'acciaio.
In definitiva, comprendere il ruolo dell'anodo—sia come palcoscenico stabile che come partecipante attivo—è la chiave per selezionare il materiale corretto per il compito.
Tabella Riassuntiva:
| Tipo di Anodo | Materiali Comuni | Proprietà Chiave | Applicazioni Principali |
|---|---|---|---|
| Anodo Inerte | Platino, Oro, Carbonio (Grafite, Carbonio Vetroso) | Stabilità Chimica, Alta Conduttività | Elettrochimica Analitica, Elettrosintesi |
| Anodo Attivo | Grafite, Silicio, Zinco, Alluminio | Reattività Controllata, Alta Capacità | Batterie agli Ioni di Litio, Anodi Sacrificali (Protezione dalla Corrosione) |
Hai difficoltà a selezionare il giusto materiale anodico per la tua applicazione specifica? KINTEK è specializzata nella fornitura di attrezzature e materiali di consumo di alta qualità per il laboratorio, inclusa un'ampia gamma di materiali per elettrodi per tutte le tue esigenze di laboratorio. Sia che tu abbia bisogno di elettrodi inerti per analisi precise o che tu stia sviluppando una tecnologia per batterie di nuova generazione, i nostri esperti possono aiutarti a trovare la soluzione ottimale. Contatta oggi il nostro team per discutere del tuo progetto e migliorare le capacità del tuo laboratorio!
Guida Visiva
Prodotti correlati
- Panno in carbonio conduttivo, carta in carbonio, feltro in carbonio per elettrodi e batterie
- Materiale per lucidatura elettrodi per esperimenti elettrochimici
- Produttore personalizzato di parti in PTFE Teflon per contenitori in PTFE
- Composito ceramico di nitruro di boro conduttivo BN per applicazioni avanzate
- Pressa Idraulica da Laboratorio Pressa per Pellet per Batterie a Bottone
Domande frequenti
- Qual è l'ambiente operativo ideale per un foglio di carbonio vetroso? Garantire prestazioni ottimali e longevità
- Quali sono i tre tipi di rivestimento? Una guida ai rivestimenti architettonici, industriali e per scopi speciali
- Quali sono le proprietà del materiale della carta di carbonio? Sbloccare alta conduttività e porosità per il tuo laboratorio
- Quali sono i quattro tipi principali di sensori? Una guida alla fonte di alimentazione e al tipo di segnale
- Come deve essere maneggiato il panno di carbonio utilizzato per l'elettrolisi ad alta temperatura dopo il funzionamento? Prevenire danni ossidativi irreversibili
















