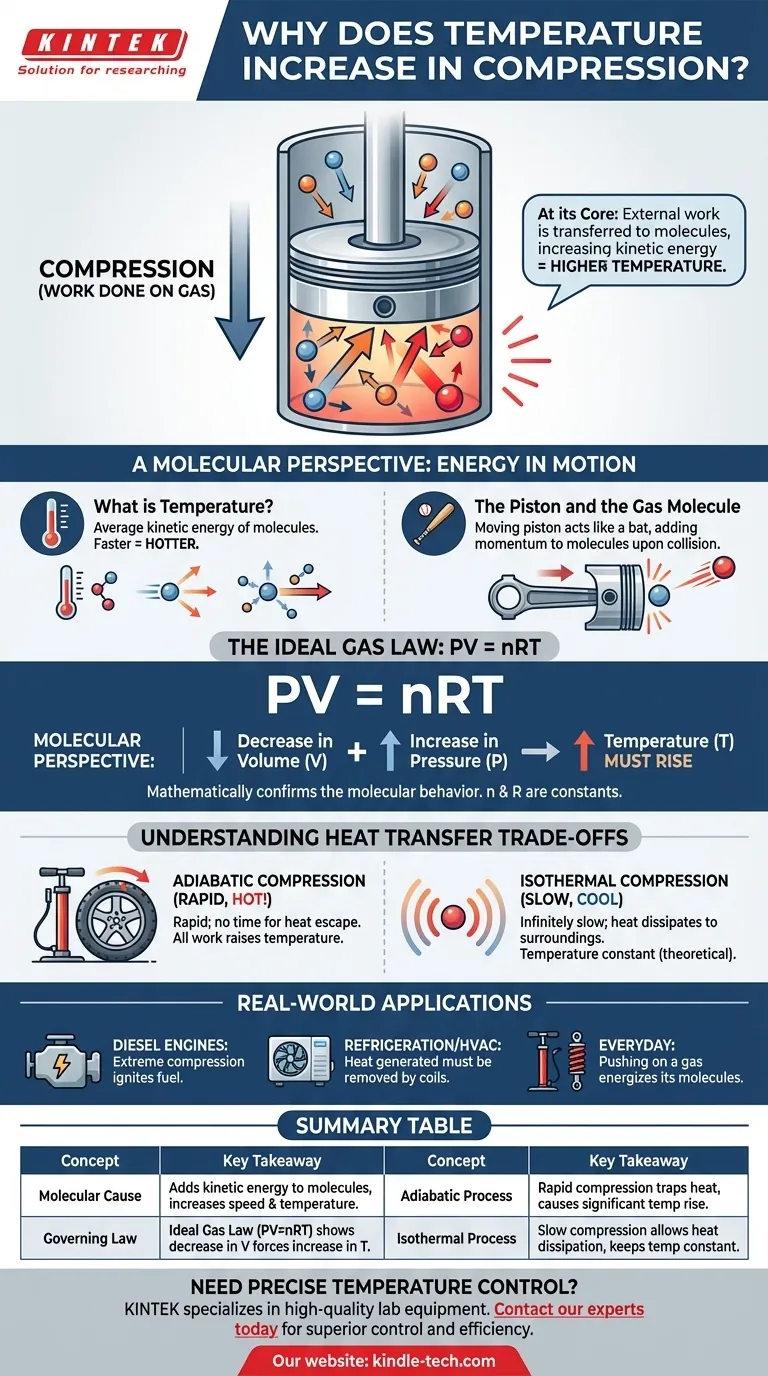
In sostanza, comprimere un gas ne aumenta la temperatura perché si sta compiendo un lavoro su di esso. Questo lavoro esterno viene trasferito direttamente alle molecole del gas, aumentandone l'energia cinetica. Misuriamo questo aumento dell'energia cinetica media delle molecole come un innalzamento della temperatura.
L'atto di compressione non è semplicemente una riduzione del volume; è un'iniezione di energia. La forza che si applica per comprimere il gas aggiunge energia alle sue molecole, facendole muovere più velocemente, cosa che percepiamo come calore.

Una prospettiva molecolare: l'energia in movimento
Per comprendere veramente il riscaldamento per compressione, dobbiamo pensare a ciò che accade alla scala delle singole molecole. La temperatura di un gas è semplicemente una misura del movimento medio delle sue innumerevoli particelle.
Cos'è veramente la temperatura?
La temperatura è una misura macroscopica dell'energia cinetica media delle molecole in un sistema. Le molecole che si muovono più velocemente possiedono più energia cinetica, con conseguente temperatura più alta. Molecole che si muovono più lentamente significano una temperatura più bassa.
L'atto della compressione
Immagina un gas contenuto in un cilindro con un pistone mobile. Per comprimere il gas, devi spingere fisicamente il pistone verso l'interno, applicando una forza su una distanza. Questa azione è la definizione scientifica di lavoro.
Il pistone e la molecola di gas
Pensa al pistone in movimento come a una mazza e a una molecola di gas come a una palla. Quando una molecola collide con un pistone fermo, rimbalza con la stessa velocità. Tuttavia, quando collide con un pistone che si sta muovendo verso l'interno, il pistone aggiunge momento ed energia alla molecola, facendola rimbalzare con una velocità maggiore.
L'effetto collettivo
Questo trasferimento di energia avviene miliardi di volte al secondo con tutte le molecole che colpiscono la faccia del pistone. Ogni collisione aggiunge una piccola quantità di energia. Il risultato cumulativo è un aumento significativo della velocità media — e quindi dell'energia cinetica media — dell'intera popolazione di molecole, causando l'aumento della temperatura del gas.
Il ruolo della legge dei gas ideali
Questo comportamento molecolare è descritto matematicamente da leggi fisiche fondamentali, più semplicemente dalla Legge dei Gas Ideali. Essa fornisce una conferma di alto livello di ciò che vediamo a livello molecolare.
L'equazione fondamentale: PV = nRT
La Legge dei Gas Ideali mette in relazione la pressione (P), il volume (V) e la temperatura (T) di una data quantità di gas (n). La 'R' è una costante. Questa equazione mostra che queste proprietà sono intrinsecamente collegate.
Come la legge prevede il risultato
Quando si comprime un gas, se ne diminuisce il volume (V). La forza che si applica aumenta anche la sua pressione (P). Affinché l'equazione PV = nRT rimanga bilanciata, un aumento sul lato sinistro dell'equazione (dalla combinazione di P che aumenta e V che diminuisce) deve essere compensato da un aumento sul lato destro. Poiché n e R sono costanti, la temperatura (T) deve aumentare.
Comprendere i compromessi: il trasferimento di calore
La velocità di compressione cambia drasticamente il risultato perché determina quanto tempo il sistema ha per interagire con l'ambiente circostante.
Compressione adiabatica (nessuna fuoriuscita di calore)
Ciò si verifica quando la compressione è così rapida che non c'è tempo per il calore generato di fuoriuscire nell'ambiente. Tutto il lavoro che si esegue viene convertito direttamente nell'aumento dell'energia interna e della temperatura del gas. Pompare una gomma da bicicletta è un esempio reale vicino; la pompa diventa notevolmente calda.
Compressione isoterma (completa fuoriuscita di calore)
Questo è un ideale teorico che si verifica quando la compressione viene eseguita infinitamente lentamente. Questo ritmo lento consente a tutto il calore extra generato dal lavoro di dissiparsi nell'ambiente circostante, mantenendo costante la temperatura del gas. Sebbene non sia praticamente ottenibile, è un concetto critico per l'analisi termodinamica.
Lo scenario del mondo reale
Quasi tutti i processi del mondo reale rientrano tra questi due estremi. Parte del lavoro svolto aumenta la temperatura interna, mentre parte del calore generato viene perso nell'ambiente.
Come applicare questo principio
Comprendere il riscaldamento per compressione non è solo accademico; è fondamentale per innumerevoli applicazioni e sistemi del mondo reale.
- Se il tuo obiettivo principale sono i fenomeni quotidiani: Ricorda che esercitare pressione su un gas (fare lavoro) energizza le sue molecole, motivo per cui una pompa per bicicletta o un ammortizzatore si surriscaldano.
- Se il tuo obiettivo principale è la progettazione di motori: Questo principio è la base stessa del motore diesel, che utilizza una compressione estrema per riscaldare l'aria a sufficienza da incendiare il carburante senza candela.
- Se il tuo obiettivo principale è la refrigerazione o l'HVAC: Il calore generato durante la fase di compressione di un refrigerante è il calore di scarto che deve essere rimosso attivamente dalle serpentine del condensatore sul retro del frigorifero o nell'unità esterna dell'aria condizionata.
In definitiva, il legame tra lavoro meccanico ed energia termica è una legge fondamentale della fisica, che trasforma la forza in calore a livello molecolare.
Tabella riassuntiva:
| Concetto | Concetto chiave |
|---|---|
| Causa molecolare | La compressione aggiunge energia cinetica alle molecole di gas, aumentandone la velocità e la temperatura. |
| Legge fondamentale | La Legge dei Gas Ideali (PV=nRT) mostra matematicamente che una diminuzione del volume (V) forza un aumento della temperatura (T). |
| Processo adiabatico | La compressione rapida (es. pompa per bicicletta) intrappola il calore, causando un significativo aumento della temperatura. |
| Processo isotermo | La compressione lenta e teorica consente al calore di dissiparsi, mantenendo costante la temperatura. |
| Impatto nel mondo reale | Fondamentale per i motori diesel, i cicli di refrigerazione e i sistemi HVAC. |
Hai bisogno di un controllo preciso della temperatura per i tuoi processi? I principi della termodinamica sono fondamentali per la R&S e le applicazioni industriali. KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio di alta qualità, al servizio delle esigenze rigorose dei laboratori. Sia che tu stia sviluppando nuovi materiali o ottimizzando sistemi termici, la nostra esperienza può supportare il tuo lavoro. Contatta oggi i nostri esperti per discutere come possiamo aiutarti a ottenere un controllo e un'efficienza superiori nel tuo laboratorio.
Guida Visiva
Prodotti correlati
- Presse Isostatiche a Caldo WIP Stazione di Lavoro 300Mpa per Applicazioni ad Alta Pressione
- Pressa a Caldo a Doppia Piastra per Laboratorio
- Stampo a pressa anti-crepa per uso di laboratorio
- Macchina comprimitrice per compresse singola e macchina comprimitrice rotativa per la produzione di massa per TDP
- Macchina per compresse elettrica a punzone singolo Laboratorio pressa per compresse TDP
Domande frequenti
- Quanta energia consuma la pressatura isostatica a caldo? Sblocca il risparmio energetico netto nel tuo processo
- Qual è il processo HIP dei materiali? Raggiungere una densità e un'affidabilità quasi perfette
- Cos'è l'HIP nella lavorazione dei materiali? Ottenere una densità quasi perfetta per i componenti critici
- Qual è il background storico del processo di pressatura isostatica a caldo (HIP)? Dalle radici nucleari allo standard industriale
- Cos'è il trattamento HIP per i metalli? Eliminare i difetti interni per prestazioni superiori del pezzo



















