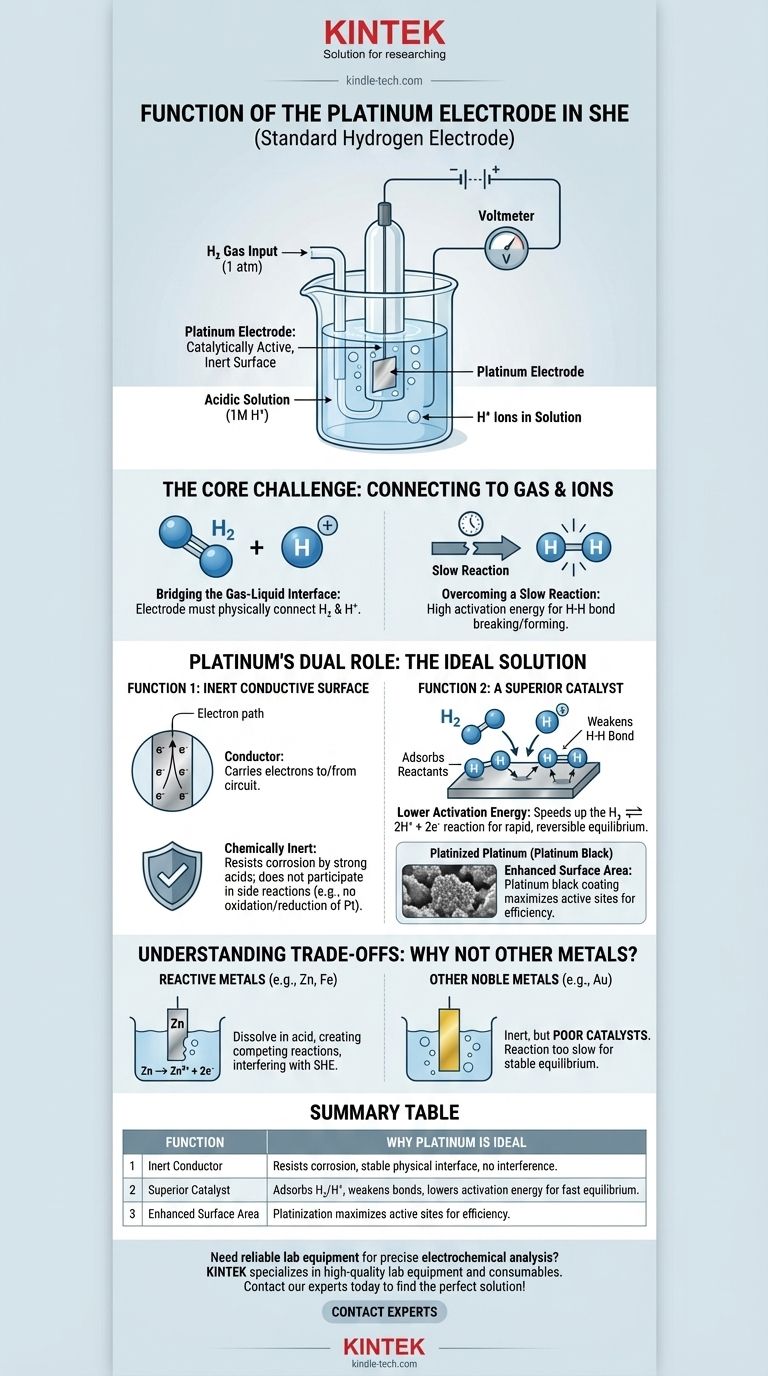
In breve, l'elettrodo di platino in un Elettrodo Standard a Idrogeno (SHE) funziona come una superficie cataliticamente attiva e inerte. Fornisce il sito fisico dove la reazione dell'idrogeno può avvenire e abbassa l'energia di attivazione richiesta, permettendo alla cella di raggiungere un equilibrio stabile e misurabile senza che l'elettrodo stesso venga consumato.
La sfida principale del SHE è creare una connessione elettrica affidabile a una reazione che coinvolge un gas (H₂) e uno ione (H⁺). Il platino è particolarmente adatto a questo ruolo perché è sia un eccellente catalizzatore per la reazione dell'idrogeno sia un conduttore chimicamente inerte, assicurando che faciliti la reazione senza interferire con essa.

La Sfida Fondamentale: Collegare un Circuito a un Gas
Per comprendere la funzione del platino, dobbiamo prima riconoscere il problema fondamentale nella costruzione di un Elettrodo Standard a Idrogeno. L'obiettivo è misurare il potenziale della reazione redox dell'idrogeno: 2H⁺(aq) + 2e⁻ ⇌ H₂(g).
Collegare l'Interfaccia Gas-Liquido
La reazione coinvolge ioni idrogeno disciolti in una soluzione acida e idrogeno gassoso gorgogliato sull'elettrodo. Un elettrodo deve esistere fisicamente in questo ambiente per fornire o accettare elettroni da un circuito esterno.
Superare una Reazione Lenta
Questa reazione dell'idrogeno non avviene rapidamente o efficientemente da sola. L'energia richiesta per rompere il legame H-H in una molecola di idrogeno o per combinare due ioni idrogeno è alta. Senza aiuto, il sistema non raggiungerebbe un equilibrio rapido e reversibile, rendendolo inutile come riferimento standard.
Il Doppio Ruolo del Platino: La Soluzione Ideale
Il platino è scelto perché risolve entrambi questi problemi contemporaneamente. Agisce sia come conduttore fisico inerte che come catalizzatore chimico attivo.
Funzione 1: Una Superficie Conduttiva Inerte
Innanzitutto, l'elettrodo deve essere un conduttore per trasportare elettroni da o verso il circuito esterno. Fondamentalmente, deve essere anche chimicamente inerte.
Non può reagire con l'acido forte (tipicamente HCl 1M) o essere ossidato o ridotto esso stesso. Il platino è un metallo nobile, il che significa che è estremamente resistente alla corrosione e alla dissoluzione, rendendolo la base fisica stabile perfetta per l'elettrodo.
Funzione 2: Un Catalizzatore Superiore
Questa è la funzione più critica del platino. Accelera drasticamente la reazione redox dell'idrogeno.
La superficie del platino assorbe sia le molecole di idrogeno gassoso (H₂) che gli ioni idrogeno (H⁺). Si pensi alla superficie del platino come a un banco da lavoro che tiene i reagenti in posizione, facilitando la loro interazione.
Adsorbendo l'idrogeno gassoso, la superficie del platino indebolisce il forte legame covalente H-H, rendendo molto più facile scindere la molecola in atomi individuali che possono poi essere ossidati a ioni H⁺. Questa azione catalitica è ciò che permette alla reazione di procedere rapidamente e reversibilmente.
Il Ruolo del "Platino Platinato"
Per massimizzare questo effetto, l'elettrodo è spesso rivestito con uno strato di polvere di platino finemente divisa, nota come nero di platino. Questo processo, chiamato platinizzazione, aumenta drasticamente la superficie effettiva dell'elettrodo, fornendo molti più siti attivi per la catalisi e garantendo che l'elettrodo funzioni in modo efficiente.
Comprendere i Compromessi: Perché Non Altri Metalli?
Esaminare perché altri metalli falliscono aiuta a chiarire perché il platino è la scelta definitiva.
Il Problema con i Metalli Reattivi
Metalli come zinco, ferro o alluminio sono altamente reattivi. Se posti nella soluzione acida del SHE, si dissolverebbero semplicemente (Zn → Zn²⁺ + 2e⁻). Questo crea una reazione elettrochimica concorrente che interferirebbe completamente con la funzione dell'elettrodo a idrogeno.
Il Problema con Altri Metalli Nobili
Altri metalli inerti, come l'oro, potrebbero servire come conduttore inerte. Tuttavia, l'oro è un catalizzatore significativamente più scadente per la reazione dell'idrogeno rispetto al platino. Mentre un elettrodo d'oro non si corroderebbe, la reazione sarebbe troppo lenta per stabilire un potenziale di equilibrio affidabile e riproducibile, vanificando lo scopo di un elettrodo "standard".
Fare la Scelta Giusta per il Tuo Obiettivo
Comprendere la doppia funzione del platino è fondamentale per afferrare i principi fondamentali dell'elettrochimica e degli standard di riferimento.
- Se il tuo focus principale è sulla cinetica di reazione: Ricorda che lo scopo principale del platino è agire come catalizzatore eterogeneo, abbassando l'energia di attivazione sia per le reazioni dirette che inverse dell'idrogeno.
- Se il tuo focus principale è sulla progettazione della cella: Ricorda che il materiale dell'elettrodo deve essere un conduttore inerte che fornisce un'interfaccia fisica stabile senza partecipare a reazioni collaterali interferenti.
La selezione del platino è una scelta ingegneristica deliberata che consente all'elettrodo a idrogeno di fungere da punto zero universale per tutte le misurazioni elettrochimiche.
Tabella Riepilogativa:
| Funzione | Perché il Platino è Ideale |
|---|---|
| Conduttore Inerte | Resiste alla corrosione in acido, fornisce un'interfaccia fisica stabile senza reazioni interferenti. |
| Catalizzatore Superiore | Adsorbe H₂ e H⁺, indebolisce i legami H-H e abbassa l'energia di attivazione per un equilibrio rapido e reversibile. |
| Superficie Aumentata | La platinizzazione (rivestimento in nero di platino) massimizza i siti attivi per prestazioni efficienti. |
Hai bisogno di attrezzature da laboratorio affidabili per analisi elettrochimiche precise? KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio di alta qualità, garantendo che il tuo laboratorio raggiunga risultati accurati e coerenti. Contatta i nostri esperti oggi stesso per trovare la soluzione perfetta per le tue esigenze di ricerca!
Guida Visiva
Prodotti correlati
- Elettrodo a foglio di platino per applicazioni di laboratorio e industriali
- Elettrodi di Riferimento Calomel Argento Cloruro Solfato di Mercurio per Uso di Laboratorio
- Elettrodo a disco rotante in platino per applicazioni elettrochimiche
- Elettrodo Ausiliario in Platino per Uso di Laboratorio
- Elettrodo a disco d'oro
Domande frequenti
- Qual è la procedura di post-trattamento corretta per un elettrodo a lamina di platino? Garantisci accuratezza a lungo termine e proteggi il tuo investimento
- Quali sono le caratteristiche prestazionali chiave e le applicazioni dei fogli di platino? Affidabilità Ineguagliabile per Applicazioni Esigenti
- Quali sono le specifiche dell'elettrodo funzionale Platino-Titanio? Massimizzare le prestazioni elettrochimiche
- Come si deve pretrattare un elettrodo a lamina di platino prima dell'uso? Assicurare Misurazioni Elettrochimiche Accurate
- Qual è la linea guida più critica per immergere un elettrodo a lamina di platino in un elettrolita? Garantire misurazioni elettrochimiche accurate



















