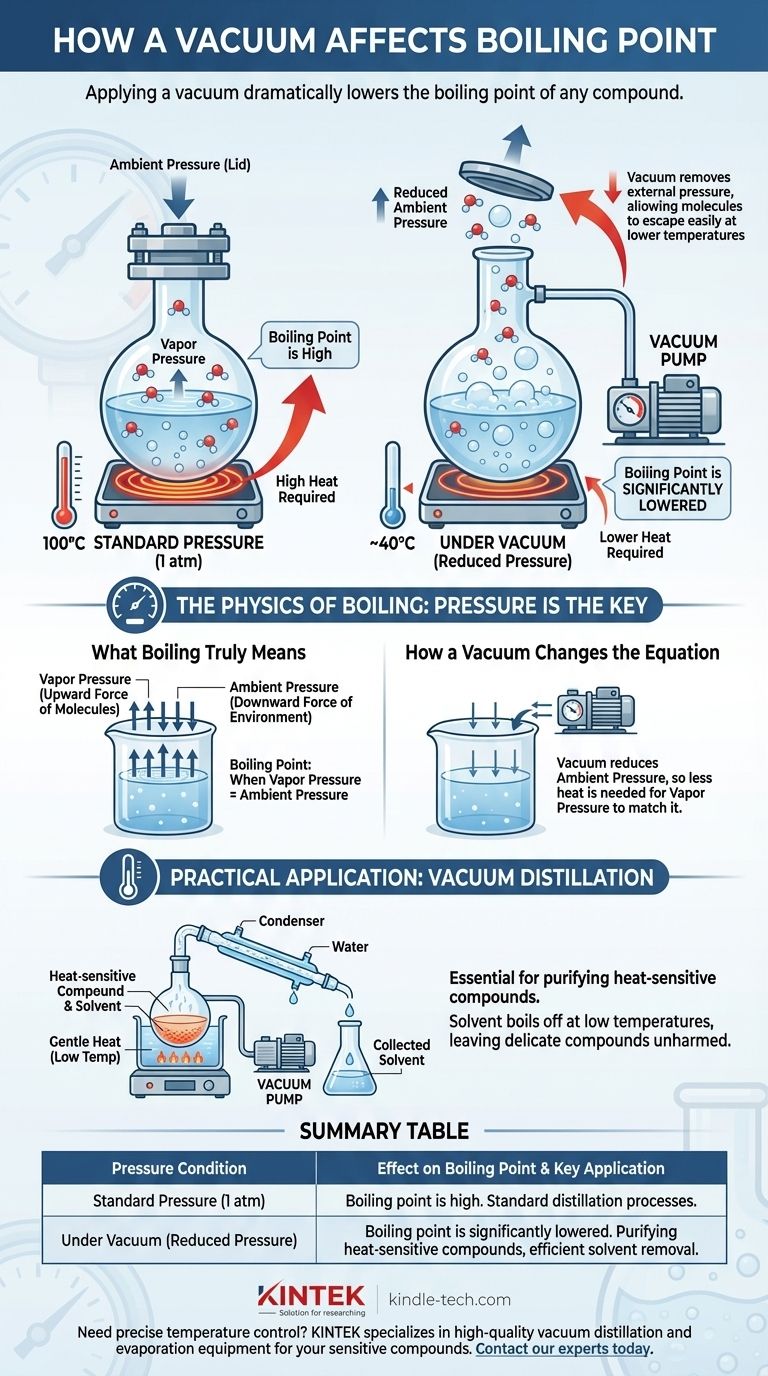
In breve, l'applicazione di un vuoto abbassa drasticamente il punto di ebollizione di qualsiasi composto. L'ebollizione non è una temperatura fissa, ma piuttosto il punto in cui la pressione di vapore interna di un liquido eguaglia la pressione esterna che preme sulla sua superficie. Creando un vuoto, si rimuove tale pressione esterna, rendendo molto più facile per le molecole sfuggire alla fase liquida e trasformarsi in gas a una temperatura molto più bassa.
Il punto di ebollizione di un liquido non è una costante; è una funzione diretta della pressione circostante. La riduzione di questa pressione con un vuoto abbassa l'energia richiesta alle molecole per passare allo stato gassoso, facendo sì che la sostanza bolla a una temperatura significativamente ridotta.

La fisica dell'ebollizione: la pressione è la chiave
Per capire perché un vuoto ha un effetto così potente, dobbiamo prima ridefinire cosa sia realmente l'"ebollizione". Si tratta meno di una temperatura specifica e più di una battaglia di pressioni.
Cosa significa veramente ebollizione
L'ebollizione è lo stato fisico specifico in cui la pressione di vapore di un liquido diventa uguale alla pressione ambiente del suo ambiente.
A questo punto di equilibrio, bolle di vapore possono formarsi all'interno della massa del liquido e salire in superficie. Questo è fondamentalmente diverso dalla semplice evaporazione, che si verifica solo sulla superficie del liquido.
Il ruolo della pressione di vapore
Ogni liquido esercita una certa pressione di vapore, che è la forza intrinseca delle sue molecole che cercano di sfuggire alla fase gassosa.
Quando si riscalda un liquido, le sue molecole acquisiscono energia cinetica. Questo aumento di energia le fa spingere più forte contro l'ambiente circostante, e quindi, la pressione di vapore aumenta con la temperatura.
Come la pressione ambiente agisce come un "coperchio"
L'atmosfera intorno a noi esercita una pressione costante su tutto, inclusa la superficie dei liquidi. Si può pensare a questa pressione ambiente come a un "coperchio" fisico che tiene ferme le molecole del liquido.
Affinché un liquido bolla, la sua pressione di vapore deve diventare abbastanza forte da "sollevare il coperchio". A livello del mare (1 atmosfera di pressione), l'acqua deve raggiungere i 100°C (212°F) per generare una pressione di vapore sufficiente a realizzare ciò.
Come un vuoto cambia l'equazione
Una pompa da vuoto funziona rimuovendo le molecole di gas da un sistema sigillato, riducendo così drasticamente la pressione ambiente. Ciò altera fondamentalmente le condizioni necessarie per l'ebollizione.
Rimuovere il "coperchio"
Applicare un vuoto equivale a sollevare quel "coperchio" di pressione. Con meno molecole di gas che spingono sulla superficie del liquido, le molecole possono fuoriuscire molto più facilmente.
Questo è lo stesso motivo per cui l'acqua bolle a una temperatura inferiore ad alta quota. La pressione atmosferica è inferiore su una montagna, quindi è necessario meno calore affinché la pressione di vapore dell'acqua la eguagli.
Il nuovo punto di ebollizione più basso
Poiché la pressione esterna è ora molto più bassa, il liquido non ha bisogno di tanta energia termica per portare la sua pressione di vapore al punto di ebollizione.
Il risultato è che la sostanza bollirà a una temperatura ben al di sotto del suo punto di ebollizione standard. Ad esempio, sotto un vuoto sufficientemente forte, l'acqua può essere fatta bollire a temperatura ambiente.
Applicazione pratica: distillazione sotto vuoto
Questo principio è essenziale in chimica per purificare composti sensibili al calore. Un chimico può sottoporre una miscela a vuoto e riscaldarla delicatamente.
Un solvente volatile evaporerà a una temperatura molto bassa, lasciando dietro di sé il composto desiderato e più delicato, che non viene mai esposto a calore elevato potenzialmente dannoso.
Comprendere i compromessi e le insidie
Sebbene potente, l'uso del vuoto per abbassare il punto di ebollizione non è privo di sfide e richiede un'attenta considerazione.
Rischio di "sbattimento" (Bumping)
Sotto vuoto, i liquidi possono bollire in modo esplosivo in un fenomeno chiamato sbattimento (bumping). Un riscaldamento non uniforme può far sì che una parte del liquido diventi surriscaldata, trasformandosi improvvisamente in vapore con forza violenta. Questo viene tipicamente gestito utilizzando sferette di ebollizione o agitazione costante.
Difficoltà con sostanze a bassa volatilità
Per le sostanze con forze intermolecolari molto deboli e quindi pressioni di vapore molto basse (come oli o liquidi ionici), anche un vuoto spinto potrebbe non abbassare il punto di ebollizione abbastanza da prevenire la decomposizione termica. Esiste un limite pratico all'utilità della tecnica.
Integrità dell'attrezzatura e delle guarnizioni
Ottenere e mantenere un vuoto profondo richiede pompe specializzate e vetreria o contenitori perfettamente sigillati. Anche una piccola perdita può compromettere la pressione del sistema, facendo aumentare inaspettatamente il punto di ebollizione.
Fare la scelta giusta per il tuo obiettivo
Manipolare la pressione è uno strumento e la sua applicazione dipende interamente dal tuo obiettivo.
- Se il tuo obiettivo principale è purificare un composto sensibile al calore: Utilizza la distillazione sotto vuoto per separare i componenti a temperature che prevengono la decomposizione o reazioni secondarie indesiderate.
- Se il tuo obiettivo principale è rimuovere efficientemente un solvente: Applica un vuoto, spesso con rotazione (come in un evaporatore rotante), per far evaporare rapidamente i solventi senza richiedere calore elevato.
- Se il tuo obiettivo principale è disidratare un materiale delicato: Utilizza un vuoto spinto per abbassare il punto di ebollizione/sublimazione dell'acqua, consentendo la disidratazione a basse temperature (liofilizzazione) che preserva la struttura del materiale.
In definitiva, comprendere la relazione tra pressione e temperatura ti dà un controllo preciso sullo stato fisico di una sostanza.
Tabella riassuntiva:
| Condizione di Pressione | Effetto sul Punto di Ebollizione | Applicazione Chiave |
|---|---|---|
| Pressione Standard (1 atm) | Il punto di ebollizione è alla sua temperatura standard, elevata. | Processi di distillazione standard. |
| Sotto Vuoto (Pressione Ridotta) | Il punto di ebollizione è significativamente abbassato. | Purificazione di composti sensibili al calore, rimozione efficiente dei solventi. |
Hai bisogno di un controllo preciso della temperatura per i tuoi composti sensibili? KINTEK è specializzata in apparecchiature di distillazione e evaporazione sottovuoto di alta qualità, inclusi evaporatori rotanti, progettati per proteggere i tuoi materiali delicati abbassando i punti di ebollizione. Le nostre attrezzature da laboratorio garantiscono un'elaborazione efficiente e sicura per ricercatori e professionisti di laboratorio. Contatta oggi i nostri esperti per trovare la soluzione sottovuoto perfetta per la tua applicazione!
Guida Visiva
Prodotti correlati
- Pompa per vuoto ad acqua circolante per uso di laboratorio e industriale
- Pompa per vuoto rotativa a palette da laboratorio per uso in laboratorio
- Pompa per vuoto a membrana oil-free per uso di laboratorio e industriale
- Pressa termica idraulica elettrica riscaldata a vuoto per laboratorio
- Valvola a sfera sottovuoto in acciaio inossidabile 304 316 Valvola di arresto per sistemi ad alto vuoto
Domande frequenti
- Qual è la differenza tra la brasatura sotto vuoto e la saldatura per diffusione? Scegliere il giusto processo di giunzione
- Qual è la temperatura dell'arco in un forno ad arco elettrico? Sfruttare un calore più caldo del sole
- Quali sono i quattro tipi di processi di trattamento termico? Ricottura completa, normalizzazione, tempra e rinvenimento
- In che modo il vuoto influisce sul trasferimento di calore? Padroneggia il Controllo Termico Preciso nel Tuo Laboratorio
- Qual è la temperatura necessaria per brasare l'acciaio inossidabile? La guida critica alla brasatura specifica per lega
- È possibile lavorare i metalli sinterizzati? Padroneggiare le tecniche per i materiali porosi
- Il fondente per brasatura è diverso dal fondente per saldatura? Una guida alla scelta del prodotto chimico giusto per la vostra giunzione
- Quali sono gli svantaggi della tempra sottovuoto? Valutare i costi e le limitazioni del trattamento termico di precisione



















