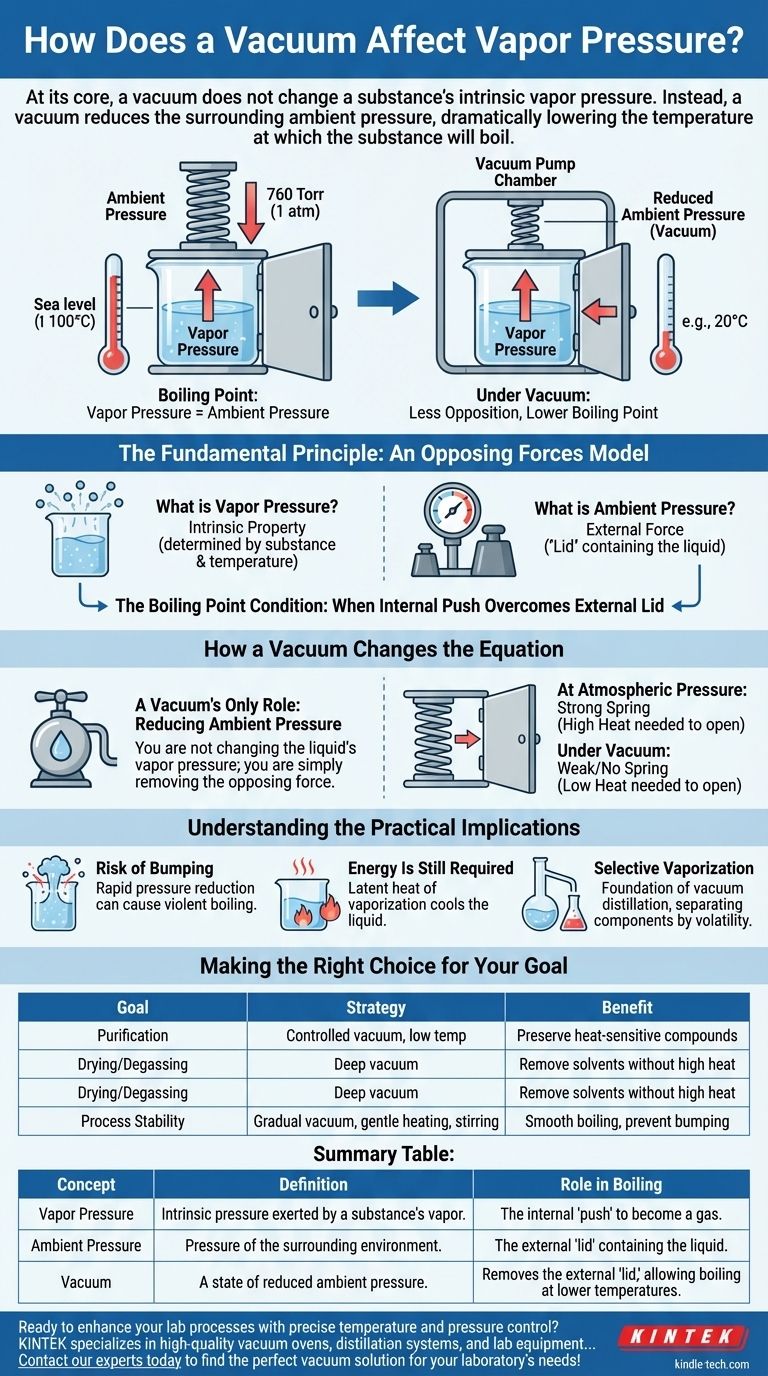
In sostanza, un vuoto non modifica la pressione di vapore intrinseca di una sostanza. Piuttosto, un vuoto riduce la pressione ambiente circostante, che abbassa drasticamente la temperatura alla quale la sostanza bolle. La pressione di vapore di una sostanza è una proprietà fondamentale determinata solo dalla sostanza stessa e dalla sua temperatura.
L'ebollizione si verifica quando la pressione di vapore interna di un liquido eguaglia o supera la pressione esterna che preme su di esso. Un vuoto rimuove semplicemente quella pressione esterna, rendendo molto più facile per la pressione di vapore del liquido "vincere" e avviare l'ebollizione, anche a temperature molto più basse.
Il Principio Fondamentale: Un Modello di Forze Opposte
Per comprendere il ruolo di un vuoto, è necessario prima distinguere tra due concetti chiave: la "spinta" interna del liquido e la "spinta" esterna dell'ambiente.
Cos'è la Pressione di Vapore?
La pressione di vapore è la pressione esercitata dal vapore di una sostanza quando è in equilibrio con la sua fase liquida o solida. Pensala come la tendenza intrinseca della sostanza a fuoriuscire e diventare un gas.
Questa proprietà è intrinseca al materiale ed è principalmente una funzione della temperatura. Man mano che si aggiunge calore, le molecole si muovono più velocemente e un numero maggiore di esse ha energia sufficiente per sfuggire alla superficie del liquido, aumentando la pressione di vapore.
Cos'è la Pressione Ambiente?
La pressione ambiente è la pressione dell'ambiente circostante che preme sulla superficie della sostanza. Al livello del mare, questo è il peso dell'atmosfera sopra di noi (circa 760 Torr o 1 atm).
Questa forza esterna agisce come un "coperchio", contenendo il liquido e rendendo più difficile la fuoriuscita delle molecole.
La Condizione del Punto di Ebollizione
Un liquido bolle quando la sua spinta interna supera il coperchio esterno. La definizione tecnica del punto di ebollizione è la temperatura alla quale la pressione di vapore eguaglia la pressione ambiente. Questa è la relazione critica da comprendere.
Come un Vuoto Modifica l'Equazione
Un sistema a vuoto non interagisce con le molecole del liquido per modificarne le proprietà intrinseche. Il suo unico compito è modificare l'ambiente esterno.
L'Unico Ruolo di un Vuoto: Ridurre la Pressione Ambiente
Una pompa per vuoto funziona rimuovendo le molecole di gas (come l'aria) da una camera sigillata. Rimuovendo queste molecole, riduce drasticamente la pressione ambiente che preme sul liquido all'interno.
Non si sta modificando la pressione di vapore del liquido; si sta semplicemente rimuovendo la forza opposta.
Raggiungere il Punto di Ebollizione Prima
Immagina di cercare di aprire una porta con una molla. La pressione di vapore è la forza che applichi alla porta e la pressione ambiente è la forza della molla che spinge indietro.
- A Pressione Atmosferica: La molla è forte. Devi spingere molto forte (aggiungere molto calore) per aprire la porta (far bollire il liquido).
- Sotto Vuoto: Hai rimosso la molla. Ora, anche una spinta delicata (una piccola quantità di calore) è sufficiente per aprire facilmente la porta.
La natura della porta non è cambiata, solo l'opposizione. Ecco perché l'acqua, che bolle a 100°C (212°F) al livello del mare, può bollire a temperatura ambiente sotto un vuoto sufficiente.
Comprendere le Implicazioni Pratiche
Applicare un vuoto è una tecnica potente, ma comporta comportamenti e limitazioni specifici che è necessario gestire.
Rischio di "Bumping" (Ebollizione Violenta)
Se la pressione viene ridotta troppo rapidamente, il liquido può surriscaldarsi. L'energia si accumula senza bollire fino a quando non erutta in un singolo evento violento noto come bumping. Ecco perché l'applicazione graduale e controllata del vuoto e l'agitazione sono fondamentali in ambito di laboratorio e industriale.
L'Energia È Ancora Necessaria
Anche sotto vuoto perfetto, l'ebollizione non è istantanea o "gratuita". Il cambiamento di fase da liquido a gas (evaporazione) richiede ancora energia, nota come calore latente di vaporizzazione. Se non c'è una fonte di calore esterna, il liquido attingerà questa energia da sé, causando un rapido calo della sua temperatura. Questo è il principio alla base della liofilizzazione.
Vaporizzazione Selettiva
Questo intero principio è il fondamento della distillazione sotto vuoto. Due liquidi con diversi punti di ebollizione possono essere separati a una bassa temperatura che impedisce loro di degradarsi. La sostanza più volatile (con maggiore pressione di vapore intrinseca) bollirà per prima sotto vuoto, lasciando indietro la sostanza meno volatile.
Fare la Scelta Giusta per il Tuo Obiettivo
Comprendere questa relazione ti permette di controllare i processi con precisione. La tua strategia dipenderà da ciò che stai cercando di ottenere.
- Se il tuo obiettivo principale è la purificazione: Utilizza un vuoto controllato per separare i componenti volatili da una miscela a basse temperature, preservando i composti sensibili al calore.
- Se il tuo obiettivo principale è l'essiccazione o la degasazione: Applica un vuoto spinto per rimuovere solventi residui come acqua o aria da un campione senza doverlo riscaldare ad alte temperature.
- Se il tuo obiettivo principale è la stabilità del processo: Combina un vuoto graduale con un leggero riscaldamento e agitazione per ottenere un'ebollizione uniforme e prevenire un bumping violento.
Padroneggiando l'interazione tra temperatura e pressione, ottieni un controllo preciso sullo stato fisico dei tuoi materiali.

Tabella Riassuntiva:
| Concetto | Definizione | Ruolo nell'Ebollizione |
|---|---|---|
| Pressione di Vapore | Pressione intrinseca esercitata dal vapore di una sostanza. | La "spinta" interna del liquido a diventare gas. |
| Pressione Ambiente | Pressione dell'ambiente circostante (es. atmosfera). | Il "coperchio" esterno che contiene il liquido. |
| Vuoto | Uno stato di pressione ambiente ridotta. | Rimuove il "coperchio" esterno, consentendo l'ebollizione a temperature più basse. |
Pronto a migliorare i tuoi processi di laboratorio con un controllo preciso di temperatura e pressione?
KINTEK è specializzata in forni a vuoto di alta qualità, sistemi di distillazione e attrezzature da laboratorio progettate per un'efficiente ebollizione, essiccazione e purificazione a bassa temperatura. Le nostre soluzioni ti aiutano a preservare i materiali sensibili al calore e a migliorare la stabilità del processo.
Contatta oggi i nostri esperti per trovare la soluzione a vuoto perfetta per le esigenze del tuo laboratorio!
Guida Visiva
Prodotti correlati
- Trappola fredda per vuoto con refrigeratore diretto
- Refrigeratore per trappola fredda a vuoto Refrigeratore per trappola fredda indiretta
- Pompa per vuoto a circolazione d'acqua verticale per uso di laboratorio
- Piastra cieca per flangia sottovuoto in acciaio inossidabile KF ISO per sistemi ad alto vuoto
- Fornace per brasatura sinterizzata a trattamento termico sotto vuoto
Domande frequenti
- Qual è lo scopo di un bagno di acqua e ghiaccio nella pirolisi a microonde? Migliorare la resa del bio-olio e l'integrità del campione
- Perché viene installata una trappola fredda a azoto liquido all'uscita del reattore? Conservazione essenziale del campione e protezione del sistema
- Perché è necessario un sistema di trappola fredda contenente isopropanolo per il gas di pirolisi? Cattura efficacemente i volatili sfuggenti
- Qual è la funzione dei sistemi di raffreddamento efficienti e delle trappole fredde nella pirolisi della plastica? Massimizzare la resa e la purezza
- Qual è il meccanismo di una trappola fredda ad alta efficienza nella pervaporazione? Ottimizza l'efficienza di cattura dei vapori



















