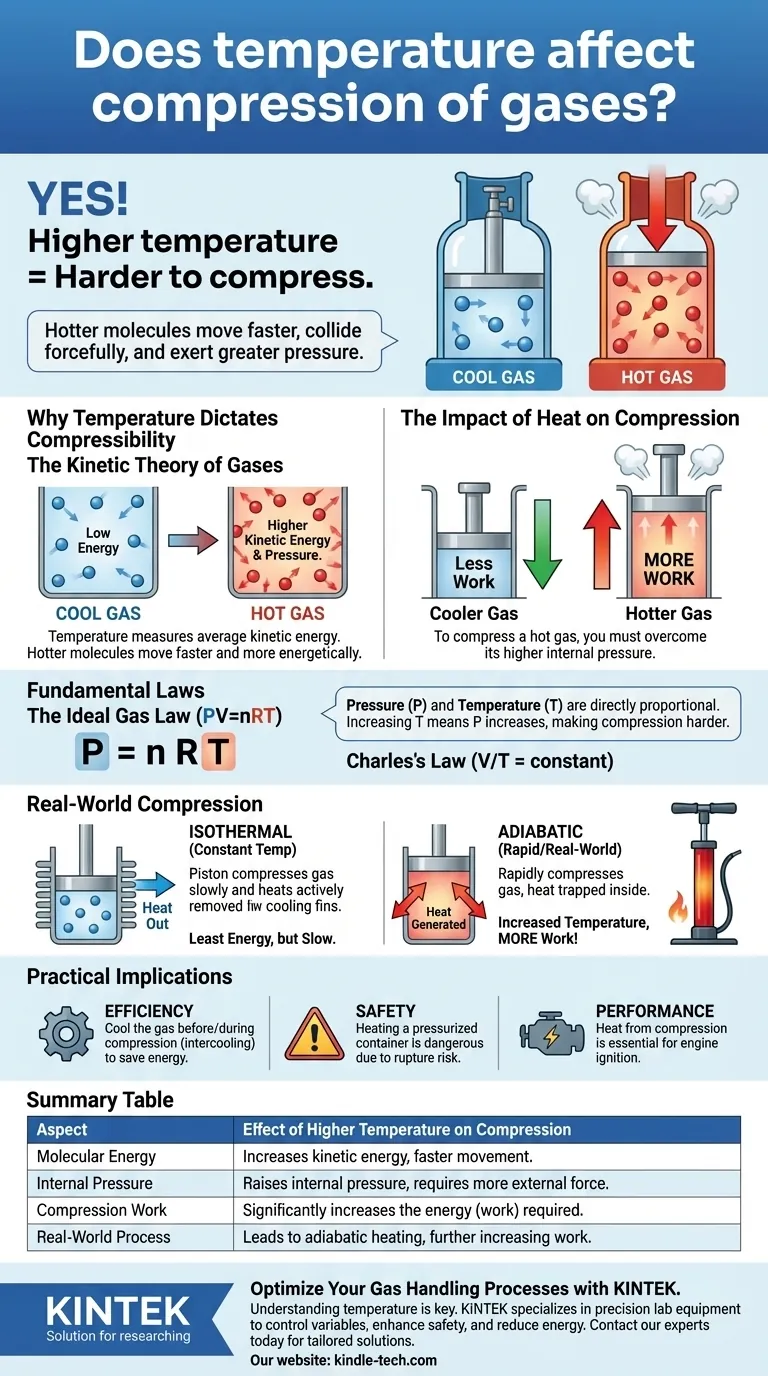
Sì, la temperatura ha un effetto diretto e critico sulla compressione dei gas. Un gas a temperatura più alta è significativamente più difficile da comprimere rispetto allo stesso gas a temperatura più bassa. Questo perché la temperatura è una misura dell'energia cinetica delle molecole di gas; le molecole più calde si muovono più velocemente, collidono con maggiore forza contro le pareti del loro contenitore e, di conseguenza, esercitano una pressione maggiore che deve essere superata.
Il principio fondamentale è che comprimere un gas richiede lavoro per vincere la pressione esercitata dalle sue molecole. Poiché un gas più caldo esercita maggiore pressione a un dato volume, richiede più lavoro per essere compresso.

Perché la temperatura determina la comprimibilità
Per comprendere la relazione tra temperatura e compressione, dobbiamo esaminare il comportamento delle molecole di gas. Questo è spiegato dalla teoria cinetica dei gas.
La Teoria Cinetica dei Gas
La temperatura è una misurazione macroscopica dell'energia cinetica media delle molecole in una sostanza. Temperature più elevate significano che le singole molecole di gas si muovono più velocemente e con maggiore energia.
Un gas freddo ha molecole con energia cinetica media inferiore, il che significa che si muovono più lentamente. Un gas caldo ha molecole con energia cinetica media superiore, facendole muovere molto più velocemente.
La Pressione come Risultato delle Collisioni Molecolari
La pressione esercitata da un gas è il risultato di innumerevoli molecole che collidono con le pareti del loro contenitore. Ogni collisione impartisce una piccola quantità di forza.
Quando le molecole sono più calde e si muovono più velocemente, colpiscono le pareti del contenitore più frequentemente e con maggiore forza, risultando in una pressione più elevata.
L'Impatto del Calore sulla Compressione
Comprimere un gas significa forzare le sue molecole in un volume più piccolo. Per fare ciò, è necessario applicare una pressione esterna maggiore della pressione interna del gas.
Poiché un gas caldo esercita naturalmente una pressione interna maggiore, è necessario applicare una forza esterna significativamente maggiore per comprimerlo allo stesso volume di un gas più freddo.
Le Leggi Fondamentali in Gioco
Questa relazione non è solo teorica; è descritta con precisione dalle leggi fondamentali dei gas che costituiscono la base della termodinamica.
La Legge dei Gas Ideali (PV=nRT)
La Legge dei Gas Ideali è l'equazione unificante: Pressione (P) × Volume (V) = moli di gas (n) × costante dei gas (R) × Temperatura (T).
Questa equazione mostra che pressione e temperatura sono direttamente proporzionali. Se si mantiene costante il volume e si aumenta la temperatura (T), anche la pressione (P) deve aumentare. Ciò conferma perché un gas più caldo è più difficile da comprimere: parte da una pressione più alta o vi aumenta.
La Legge di Charles (V/T = costante)
La Legge di Charles afferma che per una quantità fissa di gas a pressione costante, il volume è direttamente proporzionale alla sua temperatura assoluta.
Sebbene questo descriva l'espansione al riscaldamento, il suo inverso è altrettanto vero per la compressione. Per mantenere una pressione costante riducendo il volume, si dovrebbe ridurre proporzionalmente la temperatura.
Realtà Pratiche e Compromessi Chiave
Nelle applicazioni del mondo reale, il processo di compressione stesso introduce una complicazione critica: il calore.
Il Caso Idealizzato: Compressione Isoterma
La compressione isoterma presuppone che la temperatura del gas sia mantenuta perfettamente costante durante tutto il processo.
Per ottenere ciò, sarebbe necessario rimuovere attivamente e continuamente il calore generato dall'atto di compressione. Questo processo richiede la minima quantità di energia (lavoro) ma è spesso lento e poco pratico.
Il Caso del Mondo Reale: Compressione Adiabatica
In quasi tutti gli scenari di compressione rapida, come in un cilindro del motore o in una pompa per bicicletta, il processo è più vicino a quello adiabatico. Ciò significa che non viene consentito al calore di fuoriuscire dal sistema.
Tutta l'energia immessa nella compressione del gas ne aumenta l'energia interna, provocando un rapido e significativo aumento della temperatura. Ecco perché una pompa per pneumatici si surriscalda durante l'uso.
La Conseguenza: Aumento del Lavoro Richiesto
Questo riscaldamento adiabatico gioca contro di voi. Man mano che si comprime il gas, la sua temperatura aumenta, il che a sua volta aumenta ulteriormente la sua pressione interna.
Ora si sta combattendo contro una forza contraria in continuo aumento. Ecco perché la compressione nel mondo reale richiede sempre più lavoro rispetto all'ideale teorico a temperatura costante. I compressori multistadio con intercooler sono utilizzati nell'industria specificamente per contrastare questo effetto.
Fare la Scelta Giusta per il Tuo Obiettivo
Comprendere questa relazione è cruciale per l'efficienza, la sicurezza e le prestazioni in qualsiasi sistema che coinvolga gas compressi.
- Se il tuo obiettivo principale è l'efficienza industriale: Raffreddare il gas prima e durante la compressione (un processo noto come interraffreddamento) ridurrà drasticamente l'energia necessaria per comprimerlo.
- Se il tuo obiettivo principale è la sicurezza: Riconosci che riscaldare un contenitore sigillato e pressurizzato è estremamente pericoloso perché la pressione interna aumenterà proporzionalmente alla temperatura, creando un rischio di rottura.
- Se il tuo obiettivo principale sono le prestazioni del motore: Il calore generato durante la fase di compressione di un motore a combustione interna è essenziale per accendere la miscela aria-carburante, convertendo quell'energia termica in lavoro meccanico.
In definitiva, la temperatura non è una variabile passiva ma un partecipante attivo nel lavoro di compressione di un gas.
Tabella Riassuntiva:
| Aspetto | Effetto dell'Aumento della Temperatura sulla Compressione |
|---|---|
| Energia Molecolare | Aumenta l'energia cinetica, facendo muovere le molecole più velocemente. |
| Pressione Interna | Aumenta la pressione interna del gas, richiedendo una maggiore forza esterna per comprimere. |
| Lavoro di Compressione | Aumenta significativamente l'energia (lavoro) richiesta per la compressione. |
| Processo Reale | Porta al riscaldamento adiabatico, aumentando ulteriormente la resistenza e il lavoro necessario. |
Ottimizza i Tuoi Processi di Gestione dei Gas con KINTEK
Comprendere la relazione critica tra temperatura e compressione dei gas è fondamentale per l'efficienza, la sicurezza e le prestazioni in qualsiasi ambiente di laboratorio o industriale. Sia che tu stia progettando un nuovo sistema o ottimizzando uno esistente, la gestione degli effetti termici è fondamentale.
KINTEK è specializzata in apparecchiature da laboratorio di precisione e materiali di consumo che ti aiutano a controllare queste variabili. Dagli ambienti a temperatura controllata ai sistemi di compressione efficienti, le nostre soluzioni sono progettate per migliorare la sicurezza del tuo flusso di lavoro e ridurre il consumo energetico.
Lascia che ti aiutiamo a ottenere risultati superiori. Contatta oggi i nostri esperti tramite il nostro modulo di contatto per discutere come le nostre soluzioni personalizzate possono soddisfare le tue specifiche esigenze e sfide di laboratorio.
Guida Visiva
Prodotti correlati
- Produttore personalizzato di parti in PTFE Teflon per applicazioni di valvole pneumatiche
- Stampo per pressa a sfere per laboratorio
- Pressa Idraulica Manuale Riscaldata con Piastre Riscaldate per Pressa a Caldo da Laboratorio
- Pressa per stampi poligonali per laboratorio
- Macchina automatica per pressa a caldo da laboratorio
Domande frequenti
- Qual è la funzione degli O-ring in PTFE nell'idrolisi acida della cellulosa? Garantire una tenuta a prova di perdite del reattore a 250°C
- Qual è una soluzione sostenibile per ridurre i rifiuti di plastica? Una guida alla gerarchia dei rifiuti
- Perché viene selezionato uno stampo in PTFE per la preparazione di film compositi? Garantire risultati puri e privi di danni
- Perché il tubo sottile in PTFE è necessario per il controllo del flusso nell'invecchiamento di catalizzatori multicanale? Garantire una distribuzione uniforme del gas
- Perché il politetrafluoroetilene (PTFE) è preferito come materiale di rivestimento per i reattori? Garantisce la massima resistenza chimica



















