Indice dei contenuti
Introduzione alle celle elettrochimiche
Le celle elettrochimiche sono il cuore dell'accumulo e della conversione dell'energia. Sfruttano le reazioni chimiche per generare elettricità o utilizzano l'elettricità per alimentare reazioni chimiche. Queste celle sono componenti essenziali di vari sistemi elettrochimici, tra cui le batterie, le celle a combustibile e la galvanica, e sono fondamentali per i progressi delle tecnologie energetiche, dei veicoli elettrici e dell'ingegneria elettrochimica.
Tipi di celle elettrochimiche
Le celle elettrochimiche sono dispositivi che convertono l'energia chimica in energia elettrica (celle voltaiche) o viceversa (celle elettrolitiche). Sono costituite da due elettrodi, un catodo e un anodo, immersi in una soluzione elettrolitica.
Celle Voltaiche
Conosciute anche come celle galvaniche, le celle voltaiche generano elettricità da reazioni chimiche spontanee. In una cella voltaica, l'anodo è l'elettrodo negativo dove si verifica l'ossidazione, liberando elettroni. Questi elettroni fluiscono attraverso un circuito esterno verso il catodo, l'elettrodo positivo, dove avviene la riduzione. La natura spontanea della reazione spinge il flusso di elettroni e genera una corrente elettrica.
Celle elettrolitiche
Le celle elettrolitiche, invece, utilizzano l'elettricità per pilotare reazioni chimiche non spontanee. In una cella elettrolitica, il catodo è l'elettrodo negativo dove avviene la riduzione e l'anodo è l'elettrodo positivo dove avviene l'ossidazione. Una fonte di alimentazione esterna fornisce l'energia elettrica necessaria per forzare la reazione non spontanea.
Differenze chiave
Le differenze principali tra le celle voltaiche e quelle elettrolitiche sono:
- Spontaneità: Le celle voltaiche generano elettricità da reazioni spontanee, mentre le celle elettrolitiche richiedono energia esterna per pilotare reazioni non spontanee.
- Direzione del flusso di elettroni: Nelle celle voltaiche, gli elettroni fluiscono dall'anodo al catodo attraverso il circuito esterno. Nelle celle elettrolitiche, gli elettroni fluiscono dal catodo all'anodo attraverso il circuito esterno.
- Applicazioni: Le celle Voltaiche sono utilizzate nelle batterie, nelle celle solari e in altri dispositivi che generano elettricità. Le celle elettrolitiche sono utilizzate nella galvanotecnica, nella raffinazione dei metalli e in altri processi industriali.
Componenti delle celle elettrochimiche
Le celle elettrochimiche sono generalmente costituite dai seguenti componenti:
- Elettrodi: Il catodo e l'anodo, realizzati in materiali conduttivi (ad esempio, metalli, grafite).
- Elettrolita: Una soluzione o un sale fuso che conduce gli ioni, consentendo il flusso di corrente tra gli elettrodi.
- Separatore: Una barriera porosa che impedisce agli elettrodi di toccarsi direttamente, ma che consente il passaggio degli ioni.
Informazioni aggiuntive
- Il potenziale di cella, o tensione, di una cella elettrochimica è una misura della forza motrice della reazione. Nelle celle voltaiche, il potenziale di cella è positivo e indica una reazione spontanea. Nelle celle elettrolitiche, il potenziale di cella è negativo e indica una reazione non spontanea.
- L'efficienza di una cella elettrochimica è determinata da fattori quali i materiali degli elettrodi, la concentrazione dell'elettrolita e la temperatura.
- Le celle elettrochimiche svolgono un ruolo cruciale in diverse applicazioni tecnologiche, tra cui l'accumulo di energia, la sintesi chimica e la bonifica ambientale.
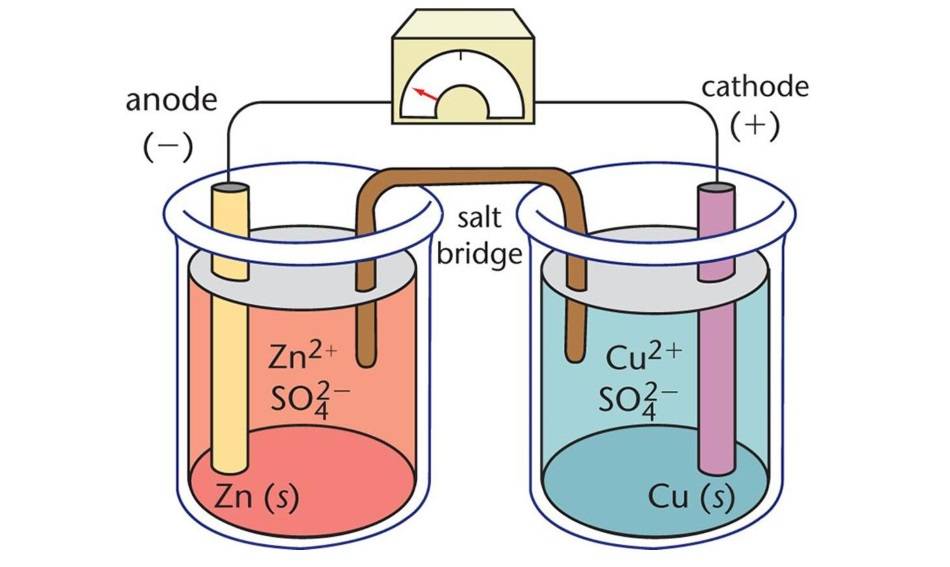
Componenti delle celle elettrolitiche
Le celle elettrolitiche, un tipo di cella elettrochimica, sono dispositivi che utilizzano l'energia elettrica per attivare reazioni chimiche non spontanee. Sono costituite da tre componenti principali: l'anodo, il catodo e l'elettrolita.
Anodo
L'anodo funge da elettrodo negativo in una cella elettrolitica. Durante la reazione elettrochimica, l'anodo rilascia elettroni al circuito esterno e subisce un'ossidazione. In altre parole, l'anodo è il punto in cui si verificano la perdita di elettroni e l'ossidazione.
Catodo
Il catodo, invece, funge da elettrodo positivo. Acquisisce gli elettroni dal circuito esterno e si riduce durante la reazione elettrochimica. Pertanto, il catodo è il luogo in cui avvengono il guadagno di elettroni e la riduzione.
Elettrolita
L'elettrolita è una sostanza che contiene ioni mobili quando è disciolta in un solvente o sciolta. Nelle celle elettrolitiche, l'elettrolita fornisce un mezzo per il flusso di ioni tra l'anodo e il catodo, completando il circuito elettrico. Gli elettroliti più comuni sono le soluzioni acquose di sali e i sali fusi.
Differenze principali dalle celle galvaniche
Le celle elettrolitiche differiscono dalle celle galvaniche per diversi aspetti chiave:
- Reazioni di cella: Le celle elettrolitiche richiedono una fonte esterna di energia elettrica per pilotare reazioni non spontanee, mentre le celle galvaniche generano energia elettrica da reazioni spontanee.
- Flusso di energia: Le celle elettrolitiche consumano energia elettrica per promuovere reazioni non spontanee, mentre le celle galvaniche convertono l'energia chimica in energia elettrica.
- Cariche degli elettrodi: Nelle celle elettrolitiche l'anodo è negativo e il catodo è positivo, mentre nelle celle galvaniche l'anodo è positivo e il catodo è negativo.
Funzionamento di una cella elettrolitica
Il funzionamento di una cella elettrolitica prevede le seguenti fasi:
- Una fonte di energia esterna (ad esempio, una batteria) viene collegata agli elettrodi della cella elettrolitica.
- La fonte di alimentazione fornisce l'energia elettrica, che aziona la reazione non spontanea.
- All'anodo si verifica l'ossidazione, che rilascia elettroni nel circuito esterno.
- Gli elettroni fluiscono attraverso il circuito esterno fino al catodo.
- Al catodo si verifica la riduzione, che consuma gli elettroni del circuito esterno.
- Gli ioni dell'elettrolita migrano per mantenere la neutralità elettrica, completando il circuito.
Applicazioni delle celle elettrolitiche
Le celle elettrolitiche hanno numerose applicazioni pratiche, tra cui:
- Galvanotecnica: Deposito di un sottile strato di metallo su una superficie a scopo decorativo o protettivo.
- Elettrolisi dell'acqua: Produzione di idrogeno e ossigeno dall'acqua, utilizzati nelle celle a combustibile e in altre applicazioni.
- Produzione di sostanze chimiche: Sintesi di vari prodotti chimici, come cloro, idrossido di sodio e alluminio.
- Raffinazione dei metalli: Purificazione dei metalli mediante la rimozione delle impurità attraverso l'elettrolisi.

Potenziali elettrodici e reazioni redox
Le celle elettrochimiche facilitano le reazioni di ossidoriduzione (redox). Esistono due forme di celle: le celle galvaniche (voltaiche), dove avvengono reazioni spontanee, e le celle elettrolitiche, dove avvengono reazioni non spontanee.
Nelle celle elettrochimiche, la reazione di ossidazione avviene all'anodo (terminale negativo), mentre la reazione di riduzione avviene al catodo (terminale positivo). Nelle celle elettrolitiche, l'anodo attira gli anioni, rendendolo positivo, mentre nelle celle galvaniche l'anodo è negativo a causa del rilascio di elettroni dalla reazione di ossidazione spontanea.
La direzione del flusso di elettroni e la spontaneità delle reazioni redox sono determinate dal potenziale elettrodico, che è la differenza di potenziale tra gli elettrodi. L'elettrodo standard di idrogeno (SHE) serve come punto di riferimento, con una tensione di 0 volt.
Il potenziale di cella, che può essere previsto utilizzando i potenziali degli elettrodi, fornisce una stima del potenziale misurato. Per calcolare il potenziale di cella, è necessario bilanciare le equazioni della reazione di semicella e determinare la differenza di tensione tra i potenziali degli elettrodi.
Il catodo e l'anodo svolgono ruoli diversi nelle celle elettrochimiche:
Catodo:
- Segno positivo dovuto al consumo di elettroni
- Si verifica la reazione di riduzione
- Gli elettroni entrano
Anodo:
- Segno negativo dovuto al rilascio di elettroni
- Si verifica la reazione di ossidazione
- Gli elettroni escono
Per convenzione, il catodo è rappresentato sul lato destro, mentre l'anodo è sul lato sinistro quando si indica una cella elettrochimica.
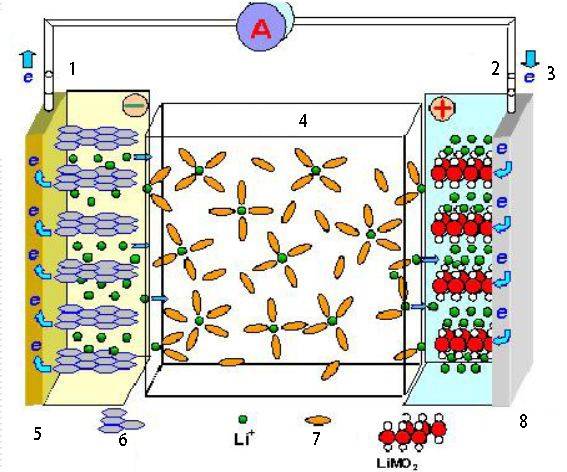
Applicazioni delle celle elettrochimiche
Le celle elettrochimiche hanno un'ampia gamma di applicazioni in vari campi, tra cui l'accumulo di energia, la conversione e i processi industriali.
Galvanotecnica
La galvanoplastica è un processo che utilizza le celle elettrochimiche per applicare un sottile strato di metallo sulla superficie di un altro metallo. Questo processo migliora le proprietà del metallo di base, come la resistenza alla corrosione, all'abrasione e all'usura. La galvanica è ampiamente utilizzata in settori quali l'industria automobilistica, l'elettronica e la gioielleria, sia per scopi funzionali che estetici.
Batterie
Le celle elettrochimiche costituiscono la base delle batterie, che sono componenti essenziali di numerosi dispositivi elettronici ed elettrodomestici. Le batterie immagazzinano energia chimica e la convertono in energia elettrica quando necessario. Sono fondamentali per l'alimentazione di dispositivi portatili, come smartphone, computer portatili e veicoli elettrici.
Elettrofiltrazione ed elettroraffinazione
Le celle elettrochimiche sono impiegate nei processi di elettrofiltrazione ed elettroraffinazione per produrre e purificare i metalli. L'elettrofiltrazione prevede l'estrazione di metalli da minerali o altre fonti mediante elettrolisi, mentre l'elettroraffinazione purifica ulteriormente i metalli rimuovendo le impurità. Questi processi sono fondamentali per ottenere metalli di elevata purezza, come rame, zinco e alluminio, essenziali per diverse applicazioni industriali.
Altre applicazioni
Le celle elettrochimiche trovano applicazione anche in diversi altri settori:
- Trattamento delle acque: Sono utilizzate nell'elettrolisi dell'acqua per produrre idrogeno gassoso e ossigeno gassoso, fondamentali per le celle a combustibile e altri processi industriali.
- Celle a combustibile: Le celle elettrochimiche sono i componenti principali delle celle a combustibile, che generano elettricità attraverso reazioni elettrochimiche che coinvolgono idrogeno e ossigeno.
- Sintesi chimica: Le celle elettrochimiche possono essere utilizzate nei processi di sintesi chimica per produrre vari prodotti chimici e materiali.
- Sensori e biosensori: Le celle elettrochimiche sono utilizzate nei sensori e nei biosensori per rilevare e analizzare sostanze specifiche in base alle loro proprietà elettrochimiche.

Conclusione
Le celle elettrochimichecon la loro capacità di convertire l'energia chimica in energia elettrica e viceversa, sono strumenti indispensabili in vari campi. Sono alla base dell'immagazzinamento e della conversione dell'energia e di numerosi processi industriali. Dalle batterie che alimentano i nostri dispositivi alle celle a combustibile che generano energia pulita, le celle elettrochimiche continuano a dare forma ai progressi tecnologici. La comprensione dei loro principi e delle loro applicazioni è fondamentale per ulteriori innovazioni nelle tecnologie energetiche, nelle soluzioni sostenibili e nell'ingegneria elettrochimica.
Prodotti correlati
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Cella Elettrochimica Elettrolitica a Diffusione di Gas Cella di Reazione a Flusso Liquido
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrolitica Elettrochimica Ottica a Finestra Laterale
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
Articoli correlati
- Capire le celle elettrolitiche al quarzo: Applicazioni, meccanismi e vantaggi
- Il Dialogo Silenzioso: Padroneggiare il Controllo nelle Celle Elettrolitiche
- Applicazioni delle celle elettrolitiche nella purificazione e nella galvanotecnica
- L'arte della resistenza: perché la tua cella elettrolitica ha bisogno di spazio per respirare
- Capire gli elettrodi e le celle elettrochimiche




















