Definizione e funzione di un elettrodo
Indice dei contenuti
Descrizione di un elettrodo
Un elettrodo è un punto in cui la corrente entra ed esce dall'elettrolita. È un conduttore utilizzato per creare una giunzione con una parte non metallica di un circuito. Gli elettrodi possono essere costituiti da materiali come oro, platino, carbonio, grafite o metallo. Servono come superficie per le reazioni di ossidoriduzione nelle celle elettrochimiche. Esistono diversi tipi di elettrodi, tra cui l'anodo e il catodo.
Ruolo di un elettrodo in una cella elettrochimica
Gli elettrodi sono componenti essenziali delle celle elettrochimiche. Trasportano gli elettroni prodotti nella cella da una semicella all'altra, creando una carica elettrica. Il catodo è l'elettrodo da cui esce la corrente, mentre l'anodo è l'elettrodo da cui entra la corrente. L'elettrolita nella cella funge da condotto per il flusso di elettroni tra il catodo e l'anodo. Il potenziale della cella è calcolato sulla base di un sistema di elettrodi standard con un potenziale di riferimento di 0 volt.

Differenza tra anodo e catodo
L'anodo e il catodo hanno ruoli diversi in una cella elettrochimica. Nelle celle elettrolitiche il catodo è carico negativamente e su questo elettrodo avviene una reazione di riduzione. Gli elettroni si spostano nel catodo durante il funzionamento della cella. Nelle celle elettrolitiche, invece, l'anodo è carico positivamente e su di esso si verifica una reazione di ossidazione. Gli elettroni escono dall'anodo durante il funzionamento della cella. È importante notare che i ruoli di anodo e catodo possono cambiare a seconda della direzione del flusso di elettroni.
In sintesi, gli elettrodi sono conduttori utilizzati nelle celle elettrochimiche per facilitare il trasferimento di elettroni. Svolgono un ruolo fondamentale nel funzionamento di queste cellule e sono classificati come anodi o catodi in base al tipo di reazione chimica che si verifica. La comprensione del ruolo e delle funzioni degli elettrodi è essenziale nello studio dell'elettrochimica.
Meccanica di un elettrodo
Processo di ossidazione e riduzione sulla superficie dell'elettrodo
Un elettrodo è una superficie metallica dove si stabilisce l'equilibrio di ossidoriduzione tra il metallo e la soluzione in cui è posto. L'elettrodo può essere un anodo o un catodo.
-
Anodo: L'anodo riceve corrente o elettroni dalla miscela elettrolitica, provocandone l'ossidazione. Quando gli atomi o le molecole si avvicinano alla superficie dell'anodo, la soluzione dona elettroni, dando luogo alla formazione di ioni positivi.
-
Catodo: il catodo, invece, rilascia elettroni nella soluzione, portando alla riduzione.
Un elettrodo deve essere stabile e resistere alla corrosione, tranne nei casi in cui l'elettrodo sia sacrificale o utilizzato per processi specifici. L'azione meccanica può causare la degradazione degli elettrodi, come il rilascio di particolato di grafite, che può richiedere la filtrazione. Anche il rigonfiamento dell'elettrodo può essere problematico con alcuni materiali.
Ruolo di anodo e catodo in questi processi
Gli anodi e i catodi svolgono un ruolo cruciale nei sistemi elettrochimici, come batterie, celle a combustibile, celle fotovoltaiche, celle elettrolitiche e diodi.

-
Anodo: L'anodo si riferisce all'elettrodo dove avviene l'ossidazione o dove fuoriescono gli elettroni. È il terminale o conduttore dove gli elettroni lasciano la cella elettrochimica, causando l'ossidazione. Nelle celle primarie, l'anodo è fisso e non può essere ricaricato, mentre nelle celle secondarie l'anodo può cambiare polarità a seconda della direzione della corrente.
-
Catodo: il catodo si riferisce all'elettrodo in cui avviene la riduzione o in cui confluiscono gli elettroni. Gli elettroni entrano nella cella al catodo e sono coinvolti nelle reazioni di riduzione. Come l'anodo, anche il catodo può cambiare polarità nelle celle secondarie.
La corrosione degli elettrodi può essere grave, soprattutto in presenza di potenziali fluttuanti nell'elettrolita o quando vengono utilizzati metalli diversi come anodo e catodo. Tuttavia, gli inibitori e altri metodi di prevenzione possono contribuire a ridurre gli attacchi agli elettrodi.
L'elettrolisi è un processo che avviene nelle celle elettrolitiche, dove l'energia elettrica viene utilizzata per eseguire reazioni chimiche non spontanee. L'ossidazione avviene all'anodo (piastra positiva), mentre la riduzione avviene al catodo (piastra negativa).
La comprensione della meccanica di un elettrodo, compresi i processi di ossidazione e riduzione, nonché il ruolo dell'anodo e del catodo, è fondamentale in varie applicazioni elettrochimiche.
Composizione del materiale di un elettrodo
Requisiti del materiale dell'elettrodo
L'efficienza delle celle elettrochimiche è determinata dalle proprietà fisiche degli elettrodi. La composizione del materiale di un elettrodo gioca un ruolo fondamentale per le sue prestazioni. Il requisito principale per un materiale elettrodico è la conduttività. Qualsiasi materiale conduttore, come metalli, semiconduttori, grafite o polimeri conduttori, può essere utilizzato come elettrodo. In molti casi, gli elettrodi sono costituiti da una combinazione di materiali, ciascuno con un compito specifico. Questi materiali comprendono:
- Materiali attivi: Sono le particelle che subiscono l'ossidazione o la riduzione nell'elettrodo.
- Agenti conduttivi: Migliorano la conduttività dell'elettrodo.
- Leganti: Servono a contenere le particelle attive all'interno dell'elettrodo.
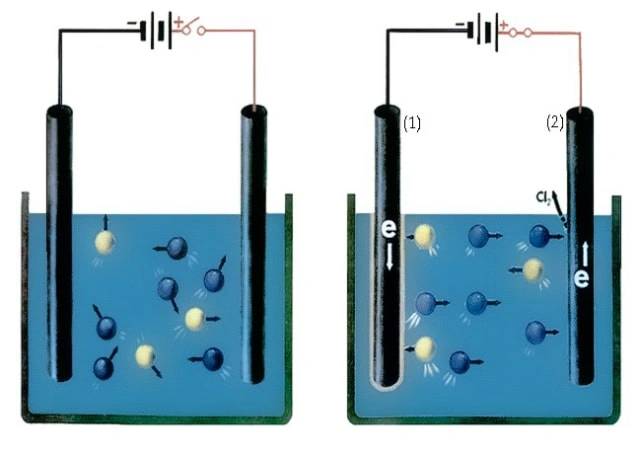
![Principio della cella elettrolitica (1.catodo 2.anodo)]()
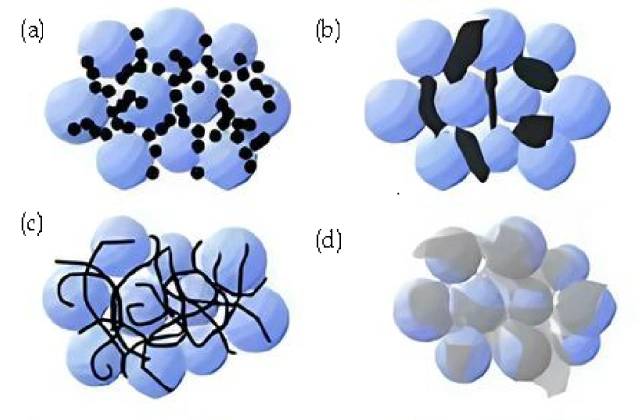
Sintesi degli agenti conduttivi (a. Nero di carbonio, nanoparticelle rigide; contatto punto-punto. b. Grafite conduttiva, particelle rigide di micron; contatto punto-punto. c. Nanotubi di carbonio, flessibili; contatto di linea e di punto d. Grafite, foglio flessibile; contatto di superficie e di punto. )
Oltre alla conducibilità, altre importanti proprietà degli elettrodi sono la resistività elettrica, la capacità termica specifica, il potenziale elettrodico e la durezza. Anche il costo del materiale è un fattore importante da considerare per le applicazioni tecnologiche.
Esempi di elettrodi inerti e reattivi
Un elettrodo può essere inerte o reattivo, a seconda del suo coinvolgimento nella reazione di ossido-riduzione (redox). Gli elettrodi inerti non partecipano alla reazione e sono chimicamente non reattivi. Esempi di elettrodi inerti sono la grafite (carbonio), il platino, l'oro e il rodio. Questi materiali vengono utilizzati quando l'unico scopo dell'elettrodo è quello di facilitare il flusso di corrente nella cella elettrochimica.
Gli elettrodi reattivi, invece, partecipano attivamente alla reazione redox. Subiscono l'ossidazione o la riduzione insieme ai reagenti. Ad esempio, un elettrodo di magnesio è un elettrodo attivo perché partecipa alla reazione. La scelta tra elettrodi inerti e reattivi dipende dai requisiti specifici del processo elettrochimico.
Ruolo dell'elettrodo nella reazione
L'elettrodo funge da piattaforma per la reazione redox. In alcuni casi, come elettrodi si utilizzano forme solide dei reagenti. Ad esempio, in una cella elettrochimica rame-argento, il rame e l'argento sono sia i reagenti che gli elettrodi. Gli elettrodi reagenti facilitano il trasferimento di elettroni e ioni durante la reazione redox.
In alternativa, nelle reazioni che richiedono un elettrodo inerte, si utilizza un metallo che non partecipa alla reazione. Un esempio è il platino nella reazione Standard Hydrogen Electrode (SHE). L'elettrodo inerte consente il flusso di corrente senza interferire con la reazione chimica.
La scelta del materiale dell'elettrodo è fondamentale per ottenere rendimenti e selettività ottimali nei processi elettrochimici. Le proprietà del materiale influenzano la cinetica e la termodinamica del trasferimento di elettroni e possono determinare il successo o il fallimento di una trasformazione. Anche considerazioni come il costo, la stabilità e la manipolabilità in varie forme giocano un ruolo nella scelta del materiale elettrodico appropriato.
La composizione del materiale e la struttura interna di un elettrodo sono fattori essenziali che ne determinano le prestazioni. La combinazione di materiali attivi, agenti conduttivi e leganti in un impasto per elettrodi ne aumenta la conduttività e la funzionalità. La miscela viene poi rivestita su un conduttore, che funge da collettore di corrente nella cella elettrochimica.
In sintesi, la composizione del materiale di un elettrodo, sia esso inerte o reattivo, ha un impatto significativo sulla sua efficienza e funzionalità nei processi elettrochimici. La scelta del materiale dell'elettrodo deve basarsi sui requisiti specifici dell'applicazione, considerando fattori quali la conduttività, la stabilità e il costo.
Esempi di elettrodi
Esempi di elettrodi inerti e reattivi di uso comune
Si può distinguere tra elettrodi attivi ed elettrodi inerti. Ad esempio, un elettrodo di magnesio è solitamente un elettrodo attivo perché partecipa alla reazione di ossido-riduzione (redox). Un elettrodo di platino è solitamente un elettrodo inerte perché non partecipa alla reazione di ossido-riduzione. Un elettrodo inerte è chimicamente non reattivo ed è presente solo per consentire il passaggio di corrente nella cella elettrochimica.
Esempi di elettrodi in chimica analitica
Esempi di materiali tipici utilizzati per gli elettrodi in chimica analitica sono il carbonio amorfo, l'oro e il platino. Gli elettrodi di vetro sono spesso utilizzati per la misurazione del pH; in questa applicazione, il vetro è drogato chimicamente per essere selettivo per gli ioni idrogeno.
Esempi di elettrodi nelle batterie
- Le batterie contengono una varietà di elettrodi, a seconda del tipo di batteria.
- Le batterie al piombo si basano su elettrodi di piombo.
- Le batterie zinco-carbone sono realizzate con elettrodi di zinco e carbonio amorfo.
![Celle fotovoltaiche, celle a combustibile e diodi]()
Le batterie ai polimeri di litio hanno elettrodi costituiti da una matrice polimerica solida all'interno della quale gli ioni di litio possono muoversi e agire come portatori di carica.
Batterie al piombo, batterie allo zinco-carbone e batterie ai polimeri di litio
- Esempi di elettrodi nell'elettrolisi
- L'energia elettrica può essere utilizzata per convertire sali e minerali in metalli.
Nel processo di Hall-Heroult per estrarre l'alluminio metallico dall'ossido di alluminio, l'anodo e il catodo sono entrambi fatti di grafite.
Il sodio metallico viene prodotto per elettrolisi utilizzando un anodo di carbonio e un catodo di ferro.
Elettrodi inerti
Un metallo che non interferisce o partecipa ad alcuna reazione chimica è noto come elettrodo inerte. Tuttavia, viene comunque utilizzato per trasferire elettricità facendo passare gli elettroni attraverso la soluzione invece di scambiare ioni.
Esempi di elettrodi inerti sono la grafite, il platino, l'oro e il rodio.
Elettrodi nell'analisi quantitativa
Nell'analisi potenziometrica, un elettrodo indicatore risponde alle differenze di attività o "concentrazione effettiva" dell'analita. Questa semplicità rende la potenziometria una tecnica economica rispetto alla spettroscopia atomica o alla cromatografia ionica. Queste procedure possono essere classificate in base agli aspetti della cellula che vengono controllati.

- Gli elettrodi sono utilizzati per fornire corrente attraverso oggetti non metallici per modificarli in numerosi modi e per misurare la conduttività per vari scopi. Alcuni esempi sono:
- Applicazioni degli elettrodi (elettrodi flessibili in rete di nanofibre, piastre bipolari di stack di celle a combustibile, EEG, ecc.)
- Elettrodi per celle a combustibile
- Elettrodi per scopi medici, come EEG (per la registrazione dell'attività cerebrale), ECG (registrazione dei battiti cardiaci), ECT (stimolazione elettrica del cervello), defibrillatore (registrazione ed erogazione della stimolazione cardiaca)
- Elettrodi per le tecniche di elettrofisiologia nella ricerca biomedica
- Elettrodi per l'esecuzione sulla sedia elettrica
- Elettrodi per la galvanotecnica
- Elettrodi per la saldatura ad arco
- Elettrodi per la protezione catodica
- Elettrodi per la messa a terra
- Elettrodi per analisi chimiche con metodi elettrochimici
- Nanoelettrodi per misurazioni di alta precisione in nanoelettrochimica
- Elettrodi inerti per elettrolisi (in platino)
Assemblaggio di elettrodi a membrana
Elettrodi per l'arma elettroshock Taser
Elettrodo standard a idrogeno (SHE)
Definizione e importanza di SHE
L'elettrodo standard per l'idrogeno (SHE) è un elettrodo che gli scienziati utilizzano come riferimento per tutte le reazioni a potenziale semicellulare. Il valore del potenziale dell'elettrodo standard è pari a zero e costituisce la base per il calcolo dei potenziali di cella utilizzando elettrodi o concentrazioni diverse. Avere un elettrodo di riferimento comune come lo SHE è fondamentale per effettuare misurazioni e confronti accurati negli esperimenti elettrochimici.
Composizione del materiale e processo di reazione dello SHE
Lo SHE è composto da una soluzione 1,0 M H+(aq) contenente un pezzo quadrato di platino platinizzato. Il platino è collegato a un filo di platino che consente lo scambio di elettroni. All'interno di un tubo di vetro, l'idrogeno gassoso viene fatto passare attraverso e nella soluzione, dando luogo alla seguente reazione:

Questo equilibrio tra ioni idrogeno e idrogeno gassoso stabilisce il potenziale di riferimento di SHE.
Elettrodo a idrogeno (1. Elettrodo di piombo 2. Ponte salino Ponte di sale 3. Elettrodo di platino nero placcato di platino (a) Elettrodo a idrogeno standard)
Sfide nell'impostazione e nell'uso dello SHE
L'impostazione e l'uso dello SHE possono presentare alcune sfide. Una sfida consiste nel garantire la stabilità dell'elettrodo di riferimento nel tempo e al variare delle temperature. I componenti dello SHE devono essere stabili e fornire potenziali elettrodici fissi e riproducibili.
Un'altra sfida risiede nella costruzione dell'elettrodo di riferimento. Lo SHE è costituito da una camicia di vetro con un piccolo ingresso nella parte superiore e molteplici uscite nella parte inferiore. All'interno della camicia di vetro, c'è un tubo di vetro sigillato ad entrambe le estremità, contenente il filo di platino platinizzato e una piastra di platino platinizzato all'estremità inferiore. La camicia di vetro e il tubo sono immersi in un recipiente contenente una soluzione di 1 M di HCl. La corretta costruzione di questi componenti è essenziale per il funzionamento accurato dello SHE.
In sintesi, l'elettrodo standard per l'idrogeno è uno strumento fondamentale in elettrochimica, in quanto serve come riferimento per misurare e confrontare i potenziali degli elettrodi. La sua costruzione e il suo utilizzo richiedono un'attenzione particolare per garantire la stabilità e l'accuratezza delle misure sperimentali.
Sistema a tre elettrodi
Il sistema a tre elettrodi è un componente essenziale della voltammetria. È costituito da tre elettrodi: l'elettrodo di lavoro, l'elettrodo di riferimento e l'elettrodo ausiliario. Ogni elettrodo svolge un ruolo specifico nel sistema.
-
Descrizione del sistema a tre elettrodiIl sistema a tre elettrodi viene utilizzato in chimica elettroanalitica per eseguire l'analisi voltammetrica. Consente di misurare e controllare il flusso di corrente in una cella elettrochimica. Il sistema è composto dai seguenti elettrodi:
-
Elettrodo di lavoro: L'elettrodo di lavoro è responsabile del trasporto di elettroni da e verso le sostanze presenti nella cella. Facilita le reazioni elettrochimiche che si verificano durante la voltammetria.
-
Elettrodo di riferimento: Un elettrodo di riferimento ha un potenziale elettrodico stabilito. Può essere utilizzato come semicella in una cella elettrochimica. Confrontando il potenziale dell'elettrodo di lavoro con quello dell'elettrodo di riferimento, è possibile determinare il potenziale dell'elettrodo di lavoro.
![Applicazioni degli elettrodi (elettrodi flessibili a maglia di nanofibre, piastre bipolari di stack di celle a combustibile, EEG, ecc.)]()
Elettrodo ausiliario
: L'elettrodo ausiliario assicura che la corrente non passi attraverso la cella di riferimento. Bilancia la corrente con quella dell'elettrodo di lavoro. L'elettrodo ausiliario è noto anche come controelettrodo.
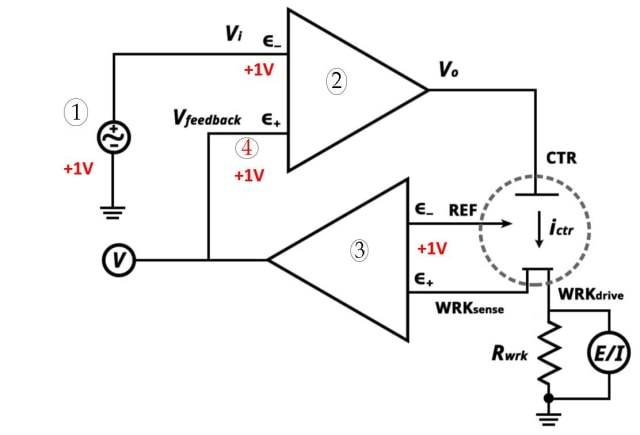
Sistema a tre elettrodi (1. Punto di regolazione potenziostatico 2. Op-Amp ad alto guadagno 3. Op-Amp ad alto guadagno). Op-Amp ad alto guadagno 3. Elettrometro 4. Molto vicino)
-
Ruolo degli elettrodi di lavoro, di riferimento e ausiliari
-
Nel sistema a tre elettrodi, ogni elettrodo ha un ruolo specifico:
-
L'elettrodo di lavoro facilita le reazioni elettrochimiche trasportando gli elettroni da e verso le sostanze presenti nella cella.
L'elettrodo di riferimento fornisce un potenziale elettrodico noto rispetto al quale è possibile misurare il potenziale dell'elettrodo di lavoro. Funge da punto di riferimento per determinare il potenziale dell'elettrodo di lavoro.
L'elettrodo ausiliario, noto anche come controelettrodo, assicura che la corrente passi attraverso la cella elettrochimica senza attraversare l'elettrodo di riferimento. Bilancia la corrente con quella dell'elettrodo di lavoro.
Il sistema a tre elettrodi offre vantaggi distinti rispetto alle configurazioni a due elettrodi. Permette di isolare l'elettrodo di lavoro, consentendo lo studio di reazioni specifiche con precisione e sicurezza. Questa configurazione è comunemente utilizzata nella sperimentazione elettrochimica.
I setup a due elettrodi, invece, sono utilizzati nei casi in cui la misura della tensione dell'intera cella è significativa, come ad esempio nei dispositivi elettrochimici per l'energia come batterie, celle a combustibile e supercondensatori. Può essere utilizzato anche quando si prevede che il potenziale del controelettrodo rimanga stabile per tutta la durata dell'esperimento.
In generale, il sistema a tre elettrodi è uno strumento cruciale nella voltammetria, che consente di misurare e controllare con precisione le reazioni elettrochimiche.
Esempi di elettrodi di riferimento

L'elettrodo al calomelano è costituito da un tubo di vetro con un'arma laterale. Sul fondo del tubo si trova del mercurio puro con un filo di platino sigillato per le connessioni elettriche. Sopra il mercurio, c'è una pasta di cloruro di mercurio (calomelano) in mercurio. Il resto del tubo è riempito con una soluzione satura di KCl. L'arma laterale serve per immergerla in qualsiasi soluzione utilizzata per l'accoppiamento dell'elettrodo di calomelano.
- elettrodo al calomelano
- Funzionamento: L'elettrodo di calomelano può agire come elettrodo negativo e sono possibili due reazioni a seconda della natura dell'altro elettrodo con cui è accoppiato. Quando agisce come elettrodo negativo, si verificano le seguenti reazioni:
2 Hg(l) → 2 Hg+ + 2 e-
2 Hg+ + 2 Cl- → Hg2Cl2(s)
- La reazione netta di ossidazione è la formazione di cloruro di mercurio.
- Vantaggi dell'elettrodo di calomelano:
- Relativamente più facile da realizzare e mantenere rispetto all'elettrodo standard per l'idrogeno (SHE).
- È composto da pasta solida e mercurio liquido, il che lo rende comodo da usare
Non richiede un ponte salino separato poiché contiene già un tubo laterale con soluzione di KCl
- Il potenziale non cambia in modo apprezzabile con il tempo e con lievi variazioni di temperatura.
- Svantaggi dell'elettrodo al calomelano:
- La compensazione del potenziale è necessaria quando si misurano i potenziali di semicella.
Non può essere utilizzato per la misurazione di potenziali in cui gli ioni K+ e Cl- interferiscono.
Il potenziale di ossidazione dipende dalla concentrazione di KCl, quindi le variazioni di concentrazione possono influenzare il potenziale dell'elettrodo.

L'elettrodo argento-cloruro d'argento è ampiamente utilizzato come elettrodo di riferimento grazie alla sua economicità e alla minore tossicità rispetto all'elettrodo di calomelano. Questo elettrodo è costituito da argento solido e dal suo sale precipitato, AgCl. Si ottiene rivestendo un filo di argento solido con AgCl e immergendolo in un tubo di soluzione di KCl e AgCl.
Elettrodo di argento-cloruro d'argento
- Funzionamento: L'elettrodo argento-cloruro d'argento consente la formazione di ioni e il flusso di elettroni all'interno e all'esterno del sistema elettrodico. Può fungere da elettrodo di riferimento se accoppiato a un altro elettrodo.
- Vantaggi dell'elettrodo argento-cloruro d'argento:
- Poco costoso e ampiamente disponibile
- Meno tossico rispetto all'elettrodo al calomelano
- Facile da configurare e riprodurre
- Comodo e facile da trasportare
- Compatto e di dimensioni ridotte, richiede poco spazio
Non è necessario un ponte salino separato, poiché contiene già un tubo laterale con soluzione di KClIl potenziale rimane relativamente stabile nel tempo e in presenza di lievi variazioni di temperatura.Elettrodi di riferimento
Prodotti correlati
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Elettrodo a foglio di platino per applicazioni di laboratorio e industriali
- Cella Elettrochimica per Corrosione Piatta
- Elettrodo a foglio d'oro per elettrochimica Elettrodo d'oro
Articoli correlati
- Tecniche avanzate di valutazione dei rivestimenti tramite celle elettrolitiche
- Il paradosso della trasparenza: padroneggiare la fragile arte delle celle elettrolitiche
- Comprendere gli elettrodi di riferimento al calomelano saturo: Composizione, usi e considerazioni
- Comprendere la corrosione piatta delle celle elettrolitiche: Applicazioni, meccanismi e tecniche di prevenzione
- L'Architettura della Precisione: Perché i Dettagli Invisibili Definiscono il Successo Elettrochimico