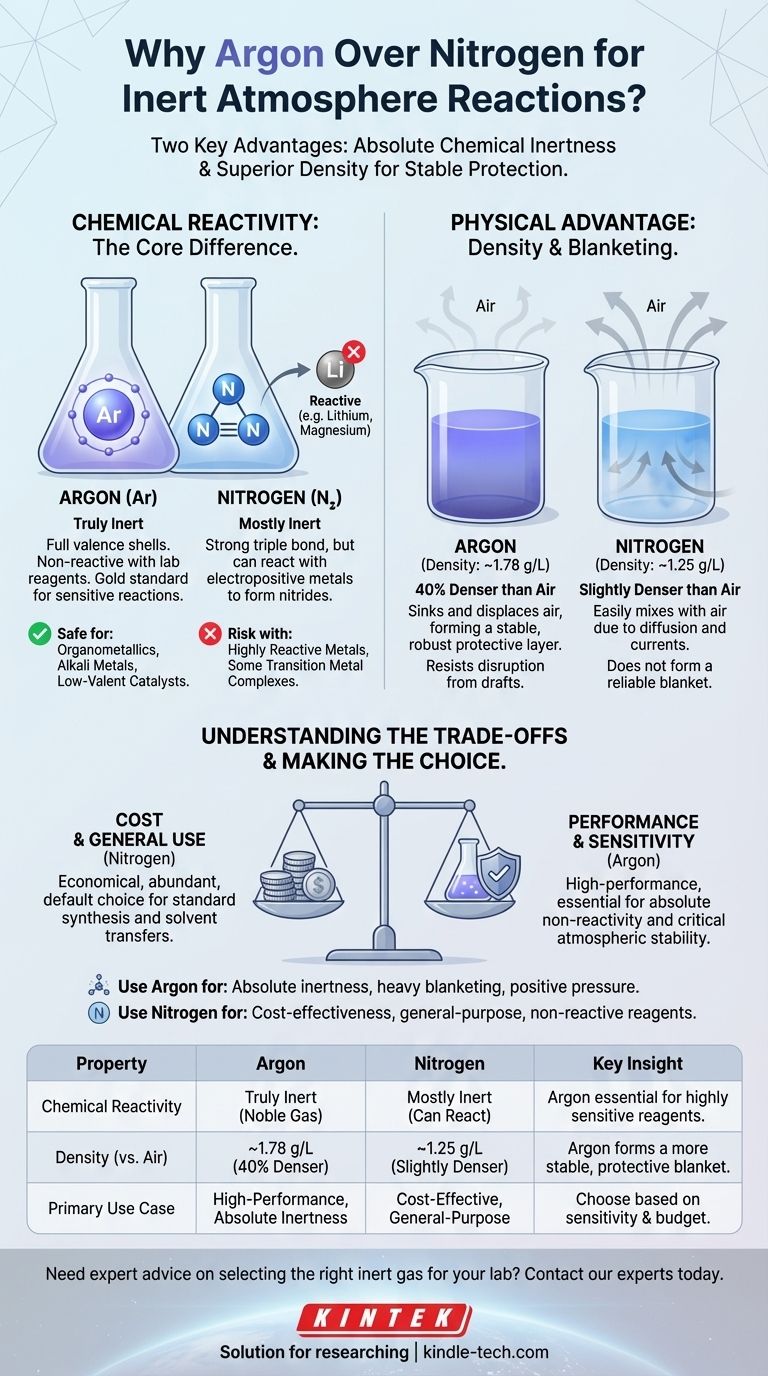
In pratica, l'argon è spesso considerato "migliore" dell'azoto per le reazioni in atmosfera inerte grazie a due proprietà chiave. L'argon è un gas nobile veramente inerte, incapace di reagire con i reagenti di laboratorio, mentre l'azoto può reagire in determinate condizioni. Inoltre, la maggiore densità dell'argon gli consente di formare una "coperta" più stabile e protettiva su una reazione, spostando l'aria in modo più efficace.
La scelta tra argon e azoto non riguarda quale sia universalmente migliore, ma quale sia più appropriato per un compito specifico. L'azoto è il cavallo di battaglia economico per l'inertizzazione generica, mentre l'argon è l'opzione ad alte prestazioni per le reazioni che richiedono assoluta non-reattività e stabilità atmosferica.

La differenza fondamentale: reattività chimica
La ragione più fondamentale per scegliere un gas rispetto all'altro si riduce al loro potenziale di partecipare alla vostra reazione.
Argon: La definizione di inerte
L'argon è un gas nobile. I suoi gusci elettronici di valenza sono completamente pieni, rendendolo eccezionalmente stabile e non reattivo in praticamente tutte le condizioni di laboratorio.
Per un chimico, questo è lo standard aureo. Si può essere certi che l'argon non interferirà con la reazione, non importa quanto siano sensibili i reagenti.
Azoto: "Prevalentemente" inerte
Il gas azoto (N₂) è composto da due atomi di azoto uniti da un legame triplo molto forte. Questo legame richiede una grande quantità di energia per essere rotto, motivo per cui l'N₂ è prevalentemente inerte e serve bene per molte applicazioni.
Tuttavia, non è completamente non reattivo. Reagenti altamente reattivi, in particolare metalli elettropositivi come litio, magnesio e alcuni complessi di metalli di transizione, possono reagire con N₂ per formare nitruri metallici. Questa reazione secondaria indesiderata può ridurre la resa o introdurre impurità.
Il vantaggio fisico: densità
Oltre alla reattività chimica, il comportamento fisico del gas in laboratorio è un fattore critico. L'aria è una miscela di gas, ma ha una densità media che possiamo confrontare.
- Densità dell'argon: ~1,78 g/L
- Densità dell'aria: ~1,23 g/L
- Densità dell'azoto: ~1,25 g/L
Come la densità crea una "coperta" protettiva
L'argon è circa il 40% più denso dell'aria. Quando si purga una beuta con argon, esso affonda efficacemente e sposta l'aria più leggera, spingendola verso l'alto e fuori. Si deposita quindi sulla miscela di reazione, formando una coperta stabile e pesante che resiste alle perturbazioni.
L'azoto, al contrario, è solo leggermente più denso dell'aria. È molto più suscettibile a mescolarsi con l'aria a causa della diffusione e di piccole correnti d'aria o correnti di convezione nella stanza. Non forma lo stesso robusto strato protettivo.
Implicazioni pratiche per le configurazioni di laboratorio
Questa differenza di densità ha conseguenze nel mondo reale. In una glovebox o su una linea Schlenk, una pressione positiva di argon fornisce un'atmosfera più tollerante. Se si verifica una piccola perdita, l'argon denso fluirà preferenzialmente all'esterno, impedendo all'aria più leggera di entrare.
Per le tecniche che si basano sulla copertura di un recipiente aperto, come in molti esperimenti elettrochimici, l'argon è di gran lunga superiore perché rimarrà depositato sulla soluzione. L'azoto si mescolerebbe semplicemente con l'aria circostante quasi immediatamente.
Comprendere i compromessi
La scelta del gas ideale richiede un equilibrio tra prestazioni e vincoli pratici.
Costo: Il fattore decisivo per molti
L'azoto costituisce circa il 78% dell'atmosfera terrestre, mentre l'argon meno dell'1%. Questa differenza di abbondanza rende l'azoto significativamente più economico da produrre e acquistare.
Per processi industriali su larga scala o procedure di laboratorio di routine in cui non è richiesta un'inerzia estrema, i risparmi sui costi derivanti dall'uso dell'azoto sono sostanziali e spesso lo rendono la scelta predefinita.
Reattività: Quando "prevalentemente" inerte è sufficiente
La potenziale reattività dell'azoto conta solo se il vostro sistema chimico è in grado di rompere quel legame triplo N≡N.
Per la stragrande maggioranza delle reazioni organiche, purificazioni e trasferimenti di solventi, l'azoto è perfettamente adeguato. I reagenti non sono semplicemente abbastanza reattivi da formare nitruri, rendendo l'argon una spesa inutile.
Fare la scelta giusta per la tua reazione
Basa la tua decisione sulle specifiche esigenze della tua procedura chimica e sulle realtà pratiche del tuo laboratorio.
- Se il tuo obiettivo principale è l'assoluta inerzia per reagenti sensibili: Usa l'argon quando lavori con organometallici (specialmente quelli che coinvolgono Li, Mg), metalli alcalini, catalizzatori di metalli di transizione a bassa valenza, o qualsiasi sistema in cui la formazione di nitruri è un rischio noto.
- Se il tuo obiettivo principale è l'efficacia dei costi e l'uso generico: Usa l'azoto per la maggior parte delle sintesi organiche standard, distillatori di solventi, ricristallizzazioni e altre procedure che non coinvolgono specie eccezionalmente reattive.
- Se il tuo obiettivo principale è mantenere un'atmosfera stabile: Usa l'argon per tecniche che richiedono una pesante coperta di gas, come l'elettrochimica, o in configurazioni in cui il mantenimento di una pressione positiva contro potenziali perdite è critico.
In definitiva, comprendere le distinte proprietà chimiche e fisiche di ciascun gas ti consente di fare la scelta più informata ed economica per il tuo esperimento.
Tabella riassuntiva:
| Proprietà | Argon | Azoto | Intuizione chiave |
|---|---|---|---|
| Reattività chimica | Veramente inerte (gas nobile) | Prevalentemente inerte, ma può reagire con metalli elettropositivi | L'argon è essenziale per reagenti altamente sensibili. |
| Densità (vs. Aria) | ~1,78 g/L (40% più denso) | ~1,25 g/L (leggermente più denso) | L'argon forma una coperta protettiva più stabile. |
| Caso d'uso primario | Reazioni ad alte prestazioni che richiedono inerzia assoluta | Soluzione economica per inertizzazione generica | Scegli in base alla sensibilità della tua reazione e al budget. |
Hai bisogno di consigli esperti sulla scelta del gas inerte giusto per la tua specifica applicazione di laboratorio?
KINTEK è specializzata nella fornitura di gas e attrezzature di laboratorio ad alta purezza, inclusi sistemi ad argon e azoto, per garantire che le tue reazioni sensibili siano perfettamente protette. Il nostro team può aiutarti a ottimizzare la tua configurazione per la massima resa e sicurezza.
Contatta i nostri esperti oggi stesso per discutere le tue esigenze di atmosfera inerte e trovare la soluzione più efficiente per il tuo laboratorio.
Guida Visiva
Prodotti correlati
- Fornace a atmosfera controllata da 1400℃ con azoto e atmosfera inerte
- Fornace a Atmosfera Controllata da 1200℃ Fornace a Atmosfera Inerte di Azoto
- Fornace a atmosfera controllata da 1700℃ Fornace a atmosfera inerte di azoto
- Fornace a Idrogeno Inertee Controllato all'Azoto
- Fornace a tubo da laboratorio ad alta temperatura da 1400℃ con tubo in allumina
Domande frequenti
- Qual è l'atmosfera di ricottura? Proteggi il tuo metallo dall'ossidazione e dalla decarburazione
- Perché è necessaria una fornace di protezione atmosferica multicanale per la simulazione SOEC? Ottenere test di ossidazione precisi
- Perché sono necessarie alte temperature durante la sinterizzazione degli acciai inossidabili? Ottieni risultati puri e ad alta densità
- Qual è la differenza tra ambienti ossidanti e riducenti? Approfondimenti chiave per le reazioni chimiche
- Qual è il ruolo dell'azoto nel processo di ricottura? Creare un'atmosfera controllata e protettiva
- Perché è necessaria una fornace ad atmosfera ad alta temperatura per il preriscaldamento del FeCrAl? Ottimizzare la forgiatura e prevenire le cricche
- Qual è la differenza tra atmosfera ossidante e riducente? Punti chiave per le vostre applicazioni
- Quali ruoli svolge un forno a tubo ad atmosfera nella rivestitura FeAl/Al2O3/TiO2? Guida esperta alla sintesi avanzata di strati



















