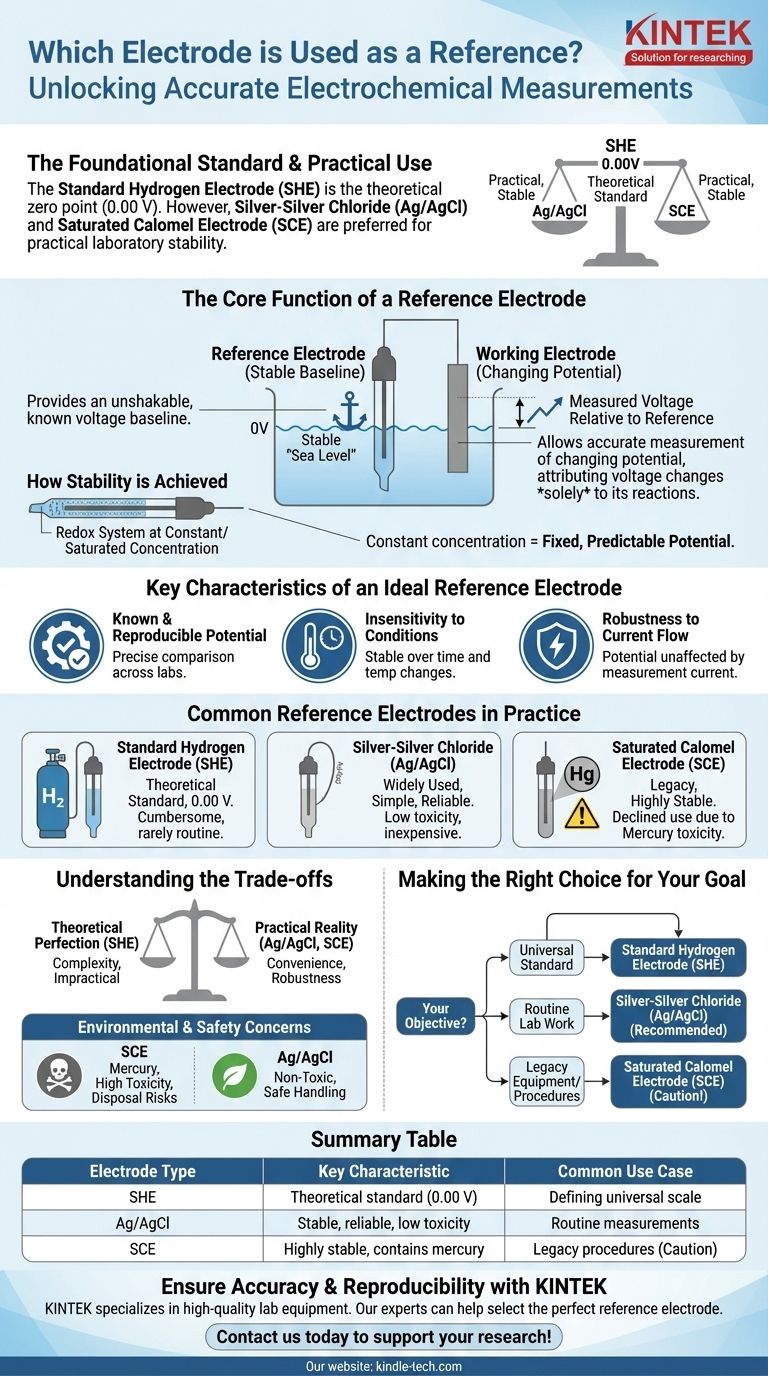
In elettrochimica, l'elettrodo di riferimento fondamentale è l'Elettrodo Standard a Idrogeno (SHE). Per convenzione universale, il suo potenziale è definito esattamente come 0,00 volt a tutte le temperature. Tuttavia, per applicazioni pratiche di laboratorio, elettrodi come l'Argento-Cloruro d'Argento (Ag/AgCl) e l'Elettrodo a Calomelano Saturato (SCE) sono molto più comuni grazie alla loro facilità d'uso e alle prestazioni stabili.
Lo scopo principale di un elettrodo di riferimento non è partecipare alla reazione primaria del tuo esperimento, ma fornire una linea di base di tensione inalterabile e nota. Agisce come un "punto zero" stabile, permettendoti di misurare accuratamente il potenziale mutevole dell'elettrodo che stai effettivamente studiando.

La Funzione Principale di un Elettrodo di Riferimento
Un elettrodo di riferimento è un componente fondamentale di quasi ogni configurazione di misurazione elettrochimica. Il suo ruolo è fornire un punto fisso rispetto al quale il potenziale di un altro elettrodo può essere determinato in modo affidabile.
Stabilire una Linea di Base Stabile
Un elettrodo di riferimento ha un potenziale elettrodico stabile e ben noto. Pensalo come il "livello del mare" per il potenziale elettrico in un sistema chimico.
Misuri l'"altezza", o potenziale, del tuo elettrodo di lavoro rispetto a questo punto di riferimento fisso e immutabile.
Consentire la Concentrazione sull'Elettrodo di Lavoro
Mantenendo un potenziale costante, l'elettrodo di riferimento assicura che qualsiasi variazione di tensione misurata nel sistema possa essere attribuita unicamente alle reazioni chimiche che avvengono all'elettrodo di lavoro.
Questo isola il fenomeno che vuoi studiare, eliminando ogni dubbio che il tuo punto di riferimento stia fluttuando.
Come si Ottiene la Stabilità
Questa elevata stabilità si ottiene utilizzando un sistema redox in cui i componenti sono mantenuti a una concentrazione costante, tipicamente satura.
Poiché le concentrazioni delle specie reagenti all'interno dell'elettrodo non cambiano, il potenziale che produce rimane fisso e prevedibile.
Caratteristiche Chiave di un Elettrodo di Riferimento Ideale
Sebbene esistano diversi tipi di elettrodi di riferimento, tutti condividono alcune caratteristiche critiche che li rendono efficaci.
Potenziale Noto e Riproducibile
Il potenziale dell'elettrodo deve essere precisamente noto e facilmente riproducibile. Questo permette agli scienziati in diversi laboratori di confrontare i loro risultati in modo significativo.
Insensibilità alle Condizioni
Il potenziale di un elettrodo di riferimento ideale dovrebbe rimanere stabile nel tempo e con moderate variazioni di temperatura.
Robustezza al Flusso di Corrente
L'elettrodo dovrebbe essere "ben equilibrato", il che significa che il suo potenziale non è influenzato dalla piccola quantità di corrente che deve fluire attraverso di esso per effettuare una misurazione. Ciò garantisce che l'atto di misurare non alteri il risultato.
Elettrodi di Riferimento Comuni nella Pratica
Mentre l'SHE è lo standard teorico, altri elettrodi sono usati per il lavoro quotidiano a causa di considerazioni pratiche.
L'Elettrodo Standard a Idrogeno (SHE)
L'SHE è lo standard assoluto rispetto al quale vengono misurati tutti gli altri potenziali degli elettrodi. È il punto zero formale della scala elettrochimica.
Nonostante la sua importanza, è ingombrante e raramente utilizzato negli esperimenti di routine perché richiede una fornitura costante di idrogeno gassoso puro e una superficie di platino appositamente preparata.
Argento-Cloruro d'Argento (Ag/AgCl)
Questo è uno degli elettrodi di riferimento più ampiamente utilizzati oggi. È apprezzato per essere semplice, economico e affidabile.
La sua bassa tossicità gli conferisce un vantaggio significativo rispetto agli elettrodi più vecchi a base di mercurio.
Elettrodo a Calomelano Saturato (SCE)
L'SCE è un altro classico elettrodo di riferimento altamente stabile che un tempo era estremamente comune.
Il suo utilizzo è diminuito significativamente a causa del fatto che contiene mercurio, un metallo pesante tossico, rendendo problematici la manipolazione e lo smaltimento.
Comprendere i Compromessi
La scelta di un elettrodo di riferimento implica bilanciare la perfezione teorica con la realtà pratica.
Lo Standard vs. Il Pratico
L'SHE fornisce le basi teoriche per l'elettrochimica, ma la sua complessità lo rende impraticabile per la maggior parte delle applicazioni. Elettrodi come Ag/AgCl offrono un'eccellente stabilità in un pacchetto molto più conveniente e robusto.
Preoccupazioni Ambientali e di Sicurezza
La ragione principale del passaggio dall'Elettrodo a Calomelano Saturato (SCE) all'elettrodo Argento-Cloruro d'Argento (Ag/AgCl) è la sicurezza. L'elevata tossicità del mercurio nell'SCE presenta significativi rischi di manipolazione e smaltimento che sono assenti con l'elettrodo Ag/AgCl.
Fare la Scelta Giusta per il Tuo Obiettivo
La scelta dell'elettrodo di riferimento dipende interamente dal tuo obiettivo, bilanciando la necessità di uno standard universale con i requisiti pratici di laboratorio.
- Se il tuo obiettivo principale è stabilire uno standard universale: L'Elettrodo Standard a Idrogeno (SHE) è il punto zero definitivo rispetto al quale vengono misurati tutti gli altri potenziali.
- Se il tuo obiettivo principale è il lavoro di laboratorio di routine: L'elettrodo Argento-Cloruro d'Argento (Ag/AgCl) è la scelta più comune grazie alla sua stabilità, basso costo e natura non tossica.
- Se stai utilizzando apparecchiature legacy o procedure stabilite specifiche: Potresti incontrare l'Elettrodo a Calomelano Saturato (SCE), ma devi rimanere consapevole del suo contenuto di mercurio.
In definitiva, la selezione dell'elettrodo di riferimento corretto è il primo passo per garantire che le tue misurazioni elettrochimiche siano accurate e riproducibili.
Tabella Riepilogativa:
| Tipo di Elettrodo | Caratteristica Chiave | Caso d'Uso Comune |
|---|---|---|
| Elettrodo Standard a Idrogeno (SHE) | Standard teorico (0,00 V) | Definizione della scala di potenziale universale |
| Argento-Cloruro d'Argento (Ag/AgCl) | Stabile, affidabile, bassa tossicità | Misurazioni di laboratorio di routine |
| Calomelano Saturato (SCE) | Altamente stabile, contiene mercurio | Procedure legacy (usare con cautela) |
Garantisci l'accuratezza e la riproducibilità dei tuoi esperimenti elettrochimici con l'elettrodo di riferimento giusto. KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio di alta qualità, fornendo soluzioni affidabili per tutte le tue esigenze di laboratorio. I nostri esperti possono aiutarti a selezionare l'elettrodo di riferimento perfetto per la tua applicazione specifica. Contattaci oggi per discutere come possiamo supportare la tua ricerca!
Guida Visiva
Prodotti correlati
- Elettrodi di Riferimento Calomel Argento Cloruro Solfato di Mercurio per Uso di Laboratorio
- Elettrodo Elettrochimico a Disco Metallico
- Elettrodo di riferimento al solfato di rame per uso di laboratorio
- Elettrodo Elettrochimico in Carbonio Vetroso
- Elettrodo Elettrochimico in Grafite, Elettrodo a Disco e Asta in Grafite
Domande frequenti
- Quali sono le precauzioni generali per l'uso di un elettrodo di riferimento? Assicurare potenziali stabili per dati accurati
- Quali sono i quattro tipi principali di sensori? Una guida alla fonte di alimentazione e al tipo di segnale
- Qual è l'elettrodo di riferimento per mercurio-cloruro di mercurio? Scopri l'elettrodo a calomelano saturo (SCE)
- Perché l'elettrodo a calomelano è utilizzato come elettrodo di riferimento secondario? Una guida pratica per misurazioni stabili
- Perché e come dovrebbero essere calibrati gli elettrodi di una cella elettrolitica? Garantire risultati affidabili



















