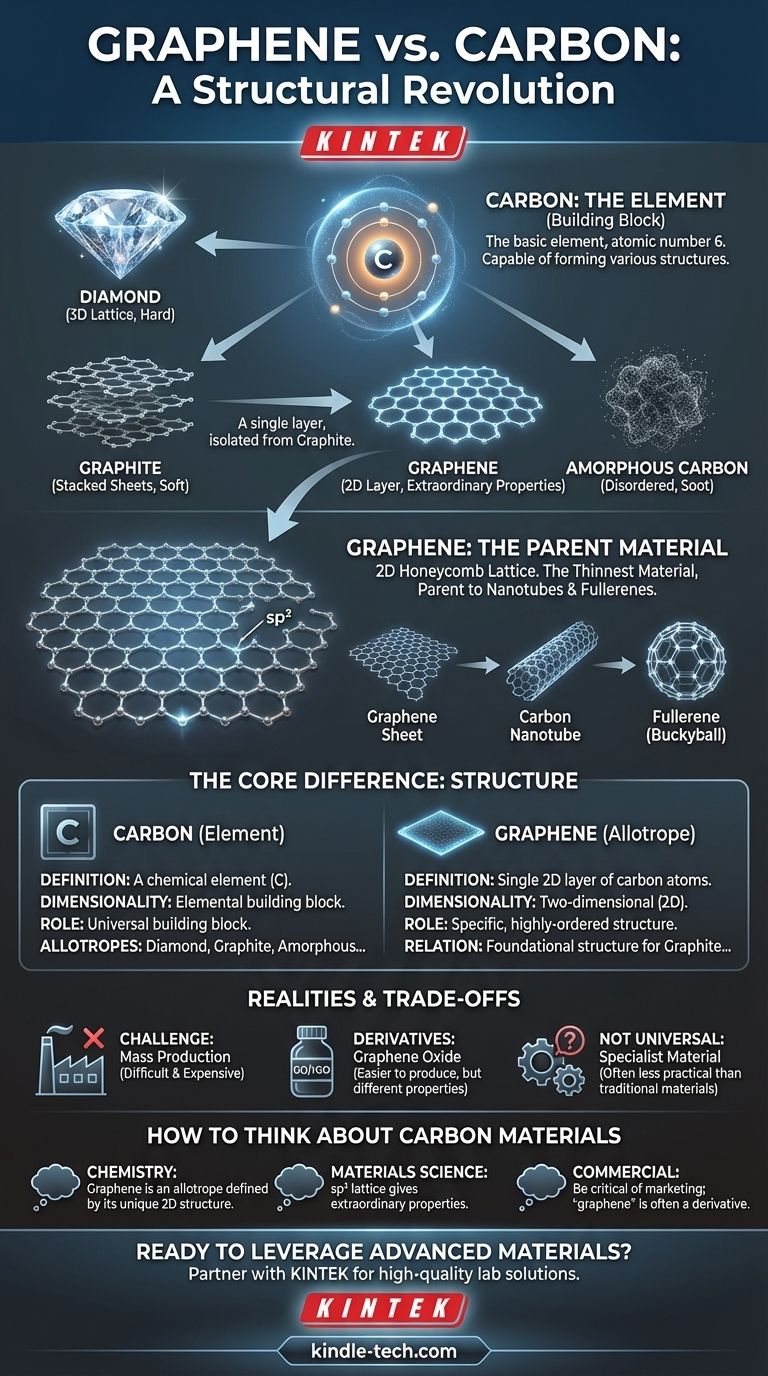
La differenza fondamentale non è di sostanza, ma di struttura. Il grafene non è un materiale diverso dal carbonio; è una specifica forma bidimensionale dell'elemento carbonio. Mentre il carbonio è l'elemento base, il grafene è un singolo strato di atomi di carbonio spesso un solo atomo, disposti in un preciso reticolo a nido d'ape, e questa disposizione unica è la fonte di tutte le sue straordinarie proprietà.
La distinzione fondamentale da ricordare è che "carbonio" è l'elemento—il mattone fondamentale—mentre "grafene" è una struttura specifica, altamente ordinata, costruita esclusivamente da quei mattoni. Pensate al diamante e alla grafite: entrambi sono carbonio puro, ma le loro diverse disposizioni atomiche conferiscono loro proprietà molto diverse.

Dall'Elemento all'Allotropo: La Fondazione del Carbonio
Per comprendere il ruolo del grafene, dobbiamo prima capire la versatilità del suo elemento genitore, il carbonio. Questo contesto è essenziale per apprezzare perché un semplice cambiamento strutturale possa creare un materiale rivoluzionario.
Carbonio: Il Mattone Universale
Il carbonio è un elemento (numero atomico 6) che si trova nella tavola periodica. La sua caratteristica distintiva è la capacità di formare forti legami covalenti con se stesso e molti altri elementi, creando un vasto numero di composti.
Nella sua forma elementare, il carbonio può esistere in diverse configurazioni strutturali.
Il Concetto di Allotropi
Queste diverse forme strutturali di un singolo elemento sono chiamate allotropi. Gli atomi sono identici, ma la loro disposizione nello spazio è diversa, portando a proprietà fisiche e chimiche drasticamente diverse.
L'esempio classico è la relazione tra la grafite morbida e grigia usata nelle matite e il diamante duro e trasparente usato in gioielleria. Entrambi sono carbonio puro, ma le loro proprietà divergono completamente a causa della loro struttura atomica.
Allotropi Comuni del Carbonio
Il grafene è solo uno dei diversi importanti allotropi del carbonio. I principali includono:
- Diamante: Gli atomi di carbonio sono disposti in un reticolo tetraedrico rigido e tridimensionale. Questo lo rende incredibilmente duro.
- Grafite: Gli atomi di carbonio sono disposti in fogli di un reticolo esagonale, che sono impilati uno sopra l'altro. Questi strati possono scivolare facilmente, rendendo la grafite morbida.
- Grafene: Un singolo strato isolato del reticolo esagonale che compone la grafite.
- Carbonio Amorfo: Una forma, come la fuliggine o il carbone, in cui gli atomi di carbonio non hanno un ordine cristallino a lungo raggio.
Cosa Rende il Grafene una Forma Unica di Carbonio?
La fama del grafene deriva dall'essere la più pura espressione del potenziale bidimensionale del carbonio. È la struttura fondamentale per altri allotropi.
Un Vero Materiale Bidimensionale
La caratteristica distintiva del grafene è che è un singolo strato atomico. Con uno spessore di un solo atomo, è il materiale più sottile mai creato, un vero piano 2D di atomi.
Il Reticolo a Nido d'Ape
Gli atomi di carbonio nel grafene sono collegati da legami sp², formando un modello esagonale perfettamente ripetitivo, molto simile a un nido d'ape o a una rete metallica. Questa struttura piatta e saldamente legata è la fonte della sua notevole stabilità e resistenza.
Il Genitore di Altri Materiali
Comprendere il grafene chiarisce la sua relazione con altre forme di carbonio. Si può pensare alla grafite semplicemente come a una pila di innumerevoli fogli di grafene. Inoltre, si può concettualmente arrotolare un foglio di grafene in un tubo per formare un nanotubo di carbonio o avvolgerlo in una sfera per formare un fullerene (buckyball).
Comprendere i Compromessi e le Realtà Pratiche
Sebbene le proprietà del grafene siano straordinarie, la sua applicazione nel mondo reale è limitata da significative sfide pratiche. Riconoscere queste limitazioni è fondamentale per una comprensione oggettiva.
La Sfida della Produzione di Massa
Produrre grandi fogli di grafene incontaminato e privo di difetti è estremamente difficile e costoso. Il famoso "metodo del nastro adesivo" utilizzato per la sua scoperta (staccare strati dalla grafite) non è scalabile per l'uso industriale.
"Grafene" vs. Derivati del Grafene
Molti prodotti commercializzati come contenenti "grafene" utilizzano in realtà materiali correlati come l'ossido di grafene (GO) o l'ossido di grafene ridotto (rGO). Questi sono più facili ed economici da produrre in massa, ma hanno proprietà elettriche e meccaniche diverse, e spesso inferiori, rispetto al grafene puro.
Non una Soluzione Universale
Il grafene è un materiale specialistico. Sebbene sia più resistente dell'acciaio e più conduttivo del rame, i suoi costi e le difficoltà di integrazione fanno sì che i materiali tradizionali rimangano più pratici ed economici per la stragrande maggioranza delle applicazioni.
Come Pensare ai Materiali al Carbonio
La vostra prospettiva sulla relazione carbonio-grafene dipende dal vostro obiettivo. Usate questi punti per inquadrare il vostro pensiero.
- Se il vostro obiettivo principale è la chimica fondamentale: Ricordate che il grafene è un allotropo dell'elemento carbonio, definito dalla sua unica struttura 2D a nido d'ape.
- Se il vostro obiettivo principale è la scienza dei materiali: Concentratevi su come il reticolo a legami
sp²del grafene dia origine a proprietà straordinarie—resistenza, conduttività e leggerezza—che sono fondamentalmente diverse dagli allotropi 3D come il diamante. - Se il vostro obiettivo principale sono i prodotti commerciali: Siate critici nei confronti delle affermazioni di marketing e comprendete che il "grafene" utilizzato è spesso un derivato, dove la sfida consiste nel raggiungere una produzione economicamente vantaggiosa su larga scala.
In definitiva, riconoscere la differenza tra il carbonio come elemento e il grafene come struttura è la chiave per comprendere una nuova classe di materiali ingegnerizzati a livello atomico.
Tabella Riassuntiva:
| Caratteristica | Carbonio (Elemento) | Grafene (Allotropo) |
|---|---|---|
| Definizione | Un elemento chimico (C) | Un singolo strato di atomi di carbonio in un reticolo 2D a nido d'ape |
| Dimensionalità | N/A (Mattone elementare) | Bidimensionale (2D) |
| Allotropi Chiave | Diamante, Grafite, Carbonio Amorfo | La struttura fondamentale per Grafite, Nanotubi di Carbonio |
| Distinzione Primaria | Il mattone universale | Una struttura specifica, altamente ordinata, fatta di atomi di carbonio |
Pronti a sfruttare materiali avanzati nella vostra ricerca?
Comprendere le sfumature di materiali come il grafene è fondamentale per l'innovazione. Presso KINTEK, siamo specializzati nella fornitura di attrezzature da laboratorio e materiali di consumo di alta qualità di cui avete bisogno per spingere i confini della scienza dei materiali. Che stiate lavorando con allotropi del carbonio o altri materiali avanzati, i nostri prodotti supportano precisione, affidabilità e scoperta.
Lasciate che KINTEK sia il vostro partner nella ricerca. Contattate i nostri esperti oggi stesso per trovare le soluzioni perfette per le sfide uniche del vostro laboratorio.
Guida Visiva
Prodotti correlati
- Agitatore Vortex da Laboratorio Agitatore Orbitale Agitatore Multifunzionale a Rotazione e Oscillazione
- Mulino a Tessuto Ibrido da Laboratorio
- Omogeneizzatore ad Alto Taglio per Applicazioni Farmaceutiche e Cosmetiche
- Produttore personalizzato di parti in PTFE Teflon per setaccio setacciante F4 in mesh PTFE
- Macchina automatica per pressa a caldo da laboratorio
Domande frequenti
- Quali sono i vantaggi dei semiconduttori di diamante? Sblocca prestazioni estreme di potenza e temperatura
- Come si crea il plasma nello sputtering? Padroneggiare la ricetta per una deposizione di film sottili efficiente
- I diamanti CVD risultano veri al test? Sì, superano i test standard per i diamanti
- Quali tipi di materiali possono essere prodotti utilizzando la deposizione chimica da vapore (CVD)? Scopri l'intero spettro della sintesi
- Qual è la temperatura del rivestimento diamantato? Massimizza le prestazioni con una gestione termica senza pari
- Quali sono gli usi dei film sottili? Sblocca nuove proprietà superficiali per i tuoi materiali
- Qual è il materiale alternativo al grafene? Scopri i migliori materiali 2D per la tua applicazione specifica
- Quali sono le proprietà del rivestimento diamantato? Sblocca prestazioni estreme per i tuoi componenti



















