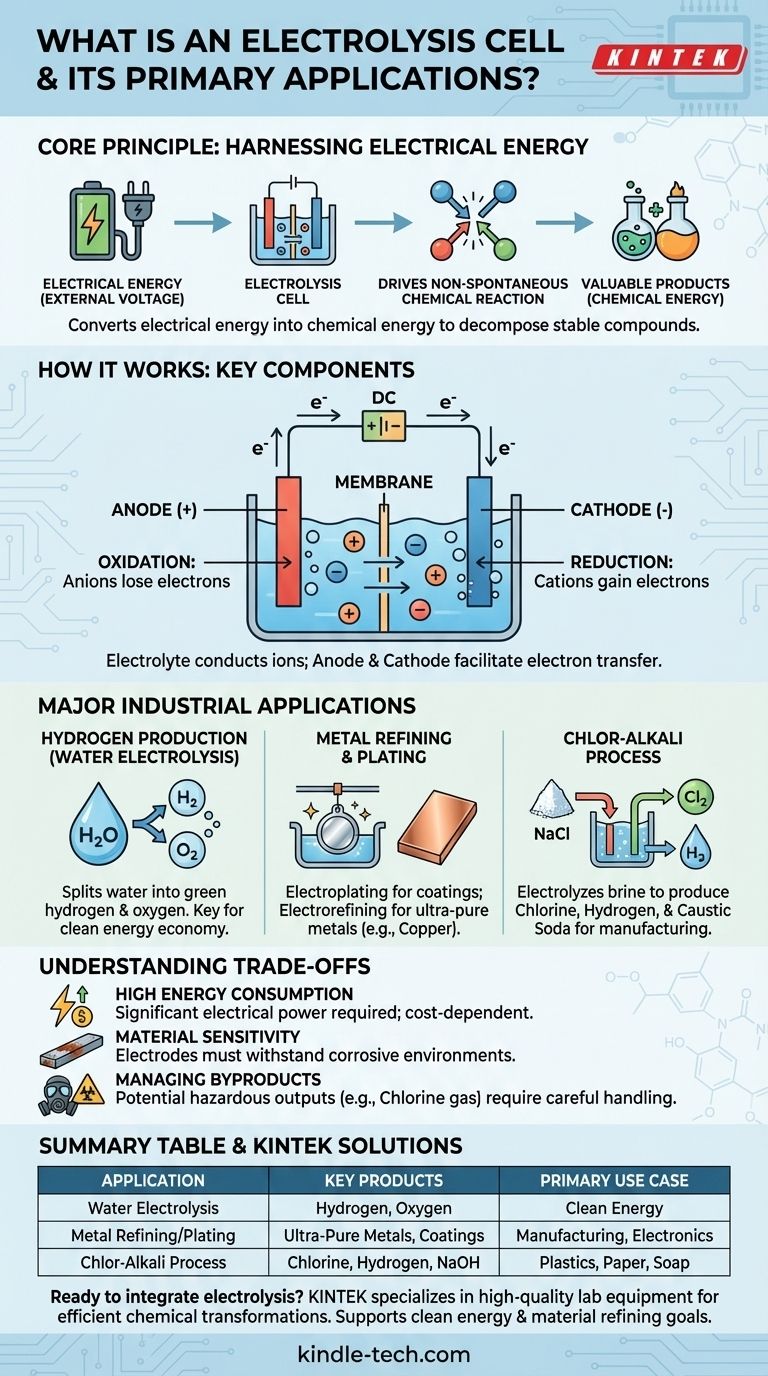
In sostanza, una cella elettrolitica è un dispositivo che sfrutta l'energia elettrica per guidare una reazione chimica che altrimenti non avverrebbe spontaneamente. Funziona facendo passare una corrente elettrica attraverso una sostanza, tipicamente una soluzione contenente ioni, per decomporla o trasformarla. Le applicazioni industriali chiave includono la produzione di idrogeno dall'acqua, la raffinazione di metalli come il rame e la produzione di sostanze chimiche essenziali come il cloro e l'idrossido di sodio.
Una cella elettrolitica converte fondamentalmente l'energia elettrica in energia chimica. Supera la stabilità naturale dei composti, utilizzando l'elettricità come strumento per scomporli e creare nuove sostanze, spesso più preziose.

Come Funziona una Cella Elettrolitica
Una cella elettrolitica opera sul principio dell'elettrolisi, che letteralmente significa "rompere con l'elettricità". Questo processo è l'opposto di ciò che accade in una batteria (una cella galvanica), che produce elettricità da una reazione chimica spontanea.
Il Principio Fondamentale: Forzare una Reazione
Molti composti chimici di valore, come l'acqua (H₂O) o il sale (NaCl), sono molto stabili. Non si decompongono spontaneamente nei loro elementi costituenti.
Una cella elettrolitica fornisce l'energia necessaria, sotto forma di tensione esterna, per forzare il verificarsi di queste reazioni non spontanee. Questo apporto energetico supera i legami chimici che tengono unito il composto.
Componenti Chiave
Ogni cella elettrolitica ha tre componenti principali:
- Anodo: L'elettrodo positivo. All'anodo, gli ioni con carica negativa (anioni) perdono elettroni in un processo chiamato ossidazione.
- Catodo: L'elettrodo negativo. Al catodo, gli ioni con carica positiva (cationi) acquistano elettroni in un processo chiamato riduzione.
- Elettrolita: Una sostanza (spesso una soluzione) contenente ioni in movimento libero. L'elettrolita conduce l'elettricità e fornisce la materia prima per la reazione.
Il tipo di elettrodi e l'elettrolita specifico utilizzato sono scelti con cura perché determinano direttamente quali prodotti verranno formati.
Principali Applicazioni Industriali
La capacità di controllare con precisione le trasformazioni chimiche con l'elettricità rende l'elettrolisi una pietra angolare dell'industria moderna.
Produzione di Idrogeno dall'Acqua
Forse l'applicazione più discussa oggi è l'elettrolisi dell'acqua. Facendo passare una corrente attraverso l'acqua (contenente un elettrolita adatto), la cella scompone le molecole di H₂O nei loro componenti.
Il gas ossigeno si forma all'anodo, mentre il gas idrogeno puro si forma al catodo. Quando l'elettricità utilizzata proviene da fonti rinnovabili, il prodotto risultante è chiamato "idrogeno verde", un componente chiave in una futura economia dell'energia pulita.
Raffinazione ed Elettrodeposizione dei Metalli
L'elettrolisi è fondamentale per produrre e purificare i metalli. Nell'elettrodeposizione (o galvanostegia), un oggetto viene posto come catodo in una cella contenente ioni del metallo di rivestimento desiderato (come cromo o nichel). Gli ioni metallici vengono ridotti sull'oggetto, formando un rivestimento sottile e resistente.
Allo stesso modo, l'elettro-raffinazione viene utilizzata per produrre metalli ultra-puri. Una lastra impura di rame, ad esempio, viene utilizzata come anodo. Quando viene applicata la corrente, gli atomi di rame si dissolvono nell'elettrolita, viaggiano verso il catodo e si ridepositano come rame puro quasi al 100%, lasciando le impurità indietro.
Il Processo Cloro-Alcali
Questo enorme processo industriale è uno degli usi più significativi dell'elettrolisi. Viene sottoposta a elettrolisi una soluzione concentrata di cloruro di sodio (salamoia).
Il risultato è la produzione di tre sostanze chimiche di base di grande valore dal semplice sale marino: gas cloro, gas idrogeno e idrossido di sodio (soda caustica). Questi sono ingredienti fondamentali per la produzione di plastica, carta, saponi e migliaia di altri prodotti.
Comprendere i Compromessi
Sebbene potente, l'elettrolisi non è una soluzione universale. La sua applicazione comporta considerazioni significative.
Elevato Consumo Energetico
Lo svantaggio principale dell'elettrolisi è il suo elevato fabbisogno energetico. Forzare la rottura di un composto stabile richiede una notevole quantità di energia elettrica, il che può rendere il processo costoso. La fattibilità economica di un processo elettrolitico è spesso direttamente collegata al costo dell'elettricità.
Sensibilità dei Materiali e Corrosione
Gli elettrodi stessi fanno parte di un ambiente chimico attivo. Devono essere in grado di resistere a condizioni corrosive e alte temperature senza degradarsi o reagire in modi indesiderati. La scelta del materiale dell'elettrodo giusto è fondamentale per l'efficienza e la longevità.
Gestione dei Sottoprodotti
L'elettrolisi può produrre sottoprodotti pericolosi o difficili da gestire. Ad esempio, nel processo cloro-alcali, il gas cloro prodotto è tossico e deve essere gestito con estrema cura. L'impatto ambientale complessivo dipende fortemente sia dalla fonte di elettricità sia dalla gestione sicura di tutti i prodotti in uscita.
Fare la Scelta Giusta per il Tuo Obiettivo
La progettazione e il funzionamento di una cella elettrolitica sono adattati specificamente al suo scopo previsto.
- Se il tuo obiettivo principale è produrre metalli di elevata purezza: Il tuo processo si concentrerà sull'elettro-raffinazione o sull'elettro-estrazione, dove il controllo preciso della tensione e la purezza dell'elettrolita sono fondamentali per garantire la qualità del prodotto.
- Se il tuo obiettivo principale è generare prodotti chimici di base: Probabilmente utilizzerai un modello come il processo cloro-alcali, ottimizzato per la produzione continua su larga scala a partire da una materia prima economica come la salamoia.
- Se il tuo obiettivo principale è creare vettori di energia pulita: I tuoi sforzi riguarderanno l'elettrolisi dell'acqua, dove l'efficienza della cella e l'integrazione con fonti di energia rinnovabile a basso costo sono i fattori più critici per il successo.
Applicando energia elettrica mirata, una cella elettrolitica trasforma input di base in output di alto valore, rendendola uno strumento fondamentale della chimica e dell'industria moderna.
Tabella Riassuntiva:
| Applicazione | Prodotti Chiave | Caso d'Uso Principale |
|---|---|---|
| Elettrolisi dell'Acqua | Gas Idrogeno e Ossigeno | Energia Pulita (Idrogeno Verde) |
| Raffinazione/Deposizione di Metalli | Metalli Ultra-Puri, Rivestimenti Protettivi | Produzione, Elettronica |
| Processo Cloro-Alcali | Cloro, Idrogeno, Idrossido di Sodio | Produzione di Plastica, Carta, Sapone |
Pronto a integrare la tecnologia di elettrolisi nel tuo laboratorio o processo industriale? KINTEK è specializzata in attrezzature e materiali di consumo di alta qualità per laboratori, fornendo gli strumenti affidabili di cui hai bisogno per trasformazioni chimiche efficienti e precise. Che tu stia sviluppando soluzioni per l'energia pulita o raffinando materiali, la nostra esperienza supporta i tuoi obiettivi. Contatta oggi il nostro team per discutere come possiamo migliorare le tue operazioni.
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Bagno d'acqua a doppio strato a cinque porte Cella elettrolitica elettrochimica
Domande frequenti
- Quale precauzione generale dovrebbe essere presa quando si maneggia la cella elettrolitica? Garantire risultati di laboratorio sicuri e accurati
- Come dovrebbe essere mantenuto il corpo di una cella elettrolitica per garantirne la longevità? Estendi la vita utile della tua attrezzatura
- Quali sono i componenti standard della cella elettrolitica a cinque porte con bagno d'acqua? Padroneggia lo strumento di precisione per l'analisi elettrochimica
- Qual è il modo corretto di maneggiare una cella elettrolitica con bagno d'acqua a cinque porte? Garantire esperimenti elettrochimici accurati e sicuri
- Come si deve far funzionare una cella elettrolitica a bagno d'acqua a cinque porte durante un esperimento? Padroneggiare il controllo preciso per risultati affidabili



















