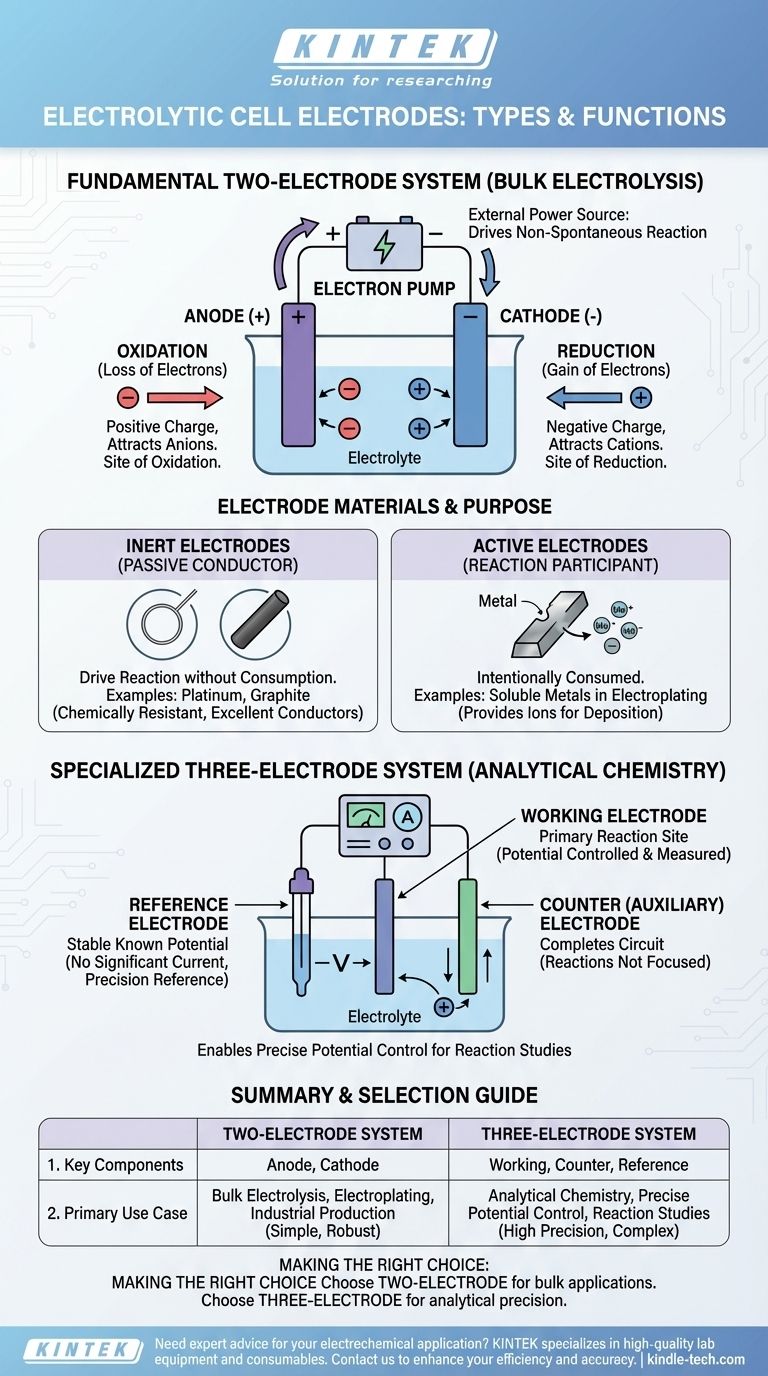
In sostanza, una cella elettrolitica utilizza due elettrodi primari: un anodo caricato positivamente dove avviene l'ossidazione, e un catodo caricato negativamente dove avviene la riduzione. Per lavori analitici più precisi, viene utilizzato un sistema a tre elettrodi, composto da un elettrodo di lavoro, un elettrodo ausiliario e un elettrodo di riferimento.
Il tipo e il numero di elettrodi utilizzati in una cella elettrolitica sono determinati dal suo scopo. Una semplice configurazione a due elettrodi (anodo e catodo) è sufficiente per avviare una reazione chimica, mentre un sistema a tre elettrodi è necessario per misurarla e controllarla con precisione.

Il fondamentale sistema a due elettrodi
La maggior parte delle celle elettrolitiche, dalle dimostrazioni in classe alla produzione su scala industriale, si basa su una fondazione a due elettrodi. Questo sistema utilizza una fonte di alimentazione esterna per forzare una reazione chimica non spontanea.
L'Anodo: Sede dell'Ossidazione
L'anodo è l'elettrodo collegato al terminale positivo della fonte di alimentazione. A causa della sua carica positiva, attrae ioni caricati negativamente (anioni) dalla soluzione elettrolitica. Sulla superficie dell'anodo, questi ioni perdono elettroni in un processo chiamato ossidazione.
Il Catodo: Sede della Riduzione
Al contrario, il catodo è collegato al terminale negativo dell'alimentatore. La sua carica negativa attrae ioni caricati positivamente (cationi). Sulla superficie del catodo, questi ioni acquisiscono elettroni in un processo noto come riduzione.
Il Ruolo della Fonte di Alimentazione Esterna
A differenza di una batteria (una cella galvanica) che genera tensione, una cella elettrolitica la consuma. La fonte di alimentazione agisce come una "pompa di elettroni", tirando elettroni dall'anodo e spingendoli al catodo, imponendo così la carica e guidando l'intero processo.
Materiali degli elettrodi e il loro scopo
Il materiale di cui è fatto un elettrodo è fondamentale per la funzione della cella. La scelta dipende dal fatto che l'elettrodo debba essere un partecipante attivo o un osservatore passivo nella reazione.
Elettrodi Inerti: Il Conduttore Passivo
In molte applicazioni, l'obiettivo è guidare una reazione all'interno dell'elettrolita senza che l'elettrodo stesso venga consumato. In questi casi, vengono utilizzati elettrodi inerti. Materiali come il platino e la grafite (una forma di carbonio) sono scelte comuni perché sono eccellenti conduttori elettrici ma sono chimicamente resistenti e improbabili a reagire.
Elettrodi Attivi: Il Partecipante alla Reazione
In alcuni processi, come l'elettrodeposizione o la raffinazione, l'anodo è intenzionalmente progettato per essere consumato. Un elettrodo attivo è fatto di un materiale che si ossida e si dissolve nell'elettrolita, fornendo gli ioni metallici che verranno successivamente depositati sul catodo.
Il sistema specializzato a tre elettrodi
Per la chimica analitica, dove l'obiettivo è studiare una reazione piuttosto che eseguire un'elettrolisi di massa, è necessario un sistema a tre elettrodi più sofisticato. Questa configurazione consente un controllo estremamente preciso del potenziale dell'elettrodo.
L'Elettrodo di Lavoro
Questo è l'elettrodo primario dove avviene la reazione di interesse. Il suo potenziale elettrico è la variabile che viene attentamente controllata e misurata.
L'Elettrodo Ausiliario (o Controelettrodo)
L'unico scopo dell'elettrodo ausiliario è completare il circuito elettrico. La corrente scorre tra l'elettrodo di lavoro e l'elettrodo ausiliario, ma le reazioni che avvengono all'elettrodo ausiliario non sono il fulcro dell'esperimento.
L'Elettrodo di Riferimento
Questa è la chiave della precisione del sistema. Un elettrodo di riferimento fornisce un potenziale elettrico stabile e noto. Nessuna corrente significativa scorre attraverso di esso, quindi il suo potenziale rimane costante. Misurando il potenziale dell'elettrodo di lavoro rispetto a questo riferimento stabile, un ricercatore può conoscere e controllare la sua tensione con alta precisione.
Comprendere i compromessi
La scelta di un sistema implica un equilibrio tra semplicità e necessità di controllo.
Il Sistema a Due Elettrodi: Semplicità per la Produzione
Questa configurazione è semplice, robusta e ideale per applicazioni su larga scala come la produzione di cloro gassoso o alluminio. La sua limitazione è la mancanza di un controllo preciso del potenziale, poiché la tensione applicata è divisa in modo imprevedibile tra i due elettrodi e l'elettrolita.
Il Sistema a Tre Elettrodi: Precisione per l'Analisi
Questo sistema offre un controllo squisito, essenziale per studiare i meccanismi di reazione ed eseguire analisi elettrochimiche sensibili. Tuttavia, è più complesso e generalmente utilizzato per lavori di laboratorio a bassa corrente, non per la produzione industriale.
Fare la scelta giusta per il tuo obiettivo
Il tuo obiettivo detta la configurazione degli elettrodi necessaria.
- Se il tuo obiettivo principale è l'elettrolisi di massa o una semplice dimostrazione (es. scissione dell'acqua, elettrodeposizione): Un sistema a due elettrodi (anodo e catodo) realizzato con materiali appropriati è la scelta corretta e più efficiente.
- Se il tuo obiettivo principale è la misurazione analitica o lo studio di un meccanismo di reazione: Un sistema a tre elettrodi (di lavoro, ausiliario, di riferimento) è essenziale per la precisione e il controllo richiesti.
In definitiva, comprendere la funzione di ciascun elettrodo ti consente di selezionare gli strumenti giusti per il compito chimico a portata di mano.
Tabella riassuntiva:
| Sistema di Elettrodi | Componenti Chiave | Caso d'Uso Primario |
|---|---|---|
| Due Elettrodi | Anodo (Ossidazione), Catodo (Riduzione) | Elettrolisi di Massa, Elettrodeposizione, Produzione Industriale |
| Tre Elettrodi | Elettrodi di Lavoro, Ausiliario, di Riferimento | Chimica Analitica, Controllo Preciso del Potenziale, Studi di Reazione |
Hai bisogno di consigli esperti sulla scelta degli elettrodi giusti per la tua applicazione elettrochimica? KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio di alta qualità per tutte le tue esigenze di laboratorio. Che tu stia allestendo per la produzione industriale o per un lavoro analitico preciso, il nostro team può aiutarti a scegliere il sistema ottimale per migliorare la tua efficienza e precisione. Contattaci oggi per discutere le tue esigenze specifiche!
Guida Visiva
Prodotti correlati
- Elettrodo di riferimento al solfato di rame per uso di laboratorio
- Elettrodo a foglio di platino per applicazioni di laboratorio e industriali
- Elettrodo a lastra di platino per applicazioni di laboratorio su batterie
- Bagno d'acqua per cella elettrochimica elettrolitica multifunzionale a strato singolo e doppio
- Collettore di corrente in foglio di alluminio per batteria al litio
Domande frequenti
- Quali sono i vantaggi e gli svantaggi dell'elettrodo di riferimento al solfato di rame a spina di legno? Velocità contro Durabilità Spiegate
- Esiste una differenza di prestazioni tra gli elettrodi al solfato di rame con tappo in legno e quelli con nucleo in ceramica? Velocità contro Durabilità spiegate
- Quali sono le procedure post-trattamento dopo l'uso di un elettrodo di riferimento al solfato di rame? Passaggi essenziali per l'accuratezza e la longevità
- Come si deve mantenere un elettrodo di riferimento al solfato di rame? Garantire misurazioni elettrochimiche accurate
- Come si deve conservare un elettrodo di riferimento a solfato di rame? Una guida alla conservazione a breve e lungo termine