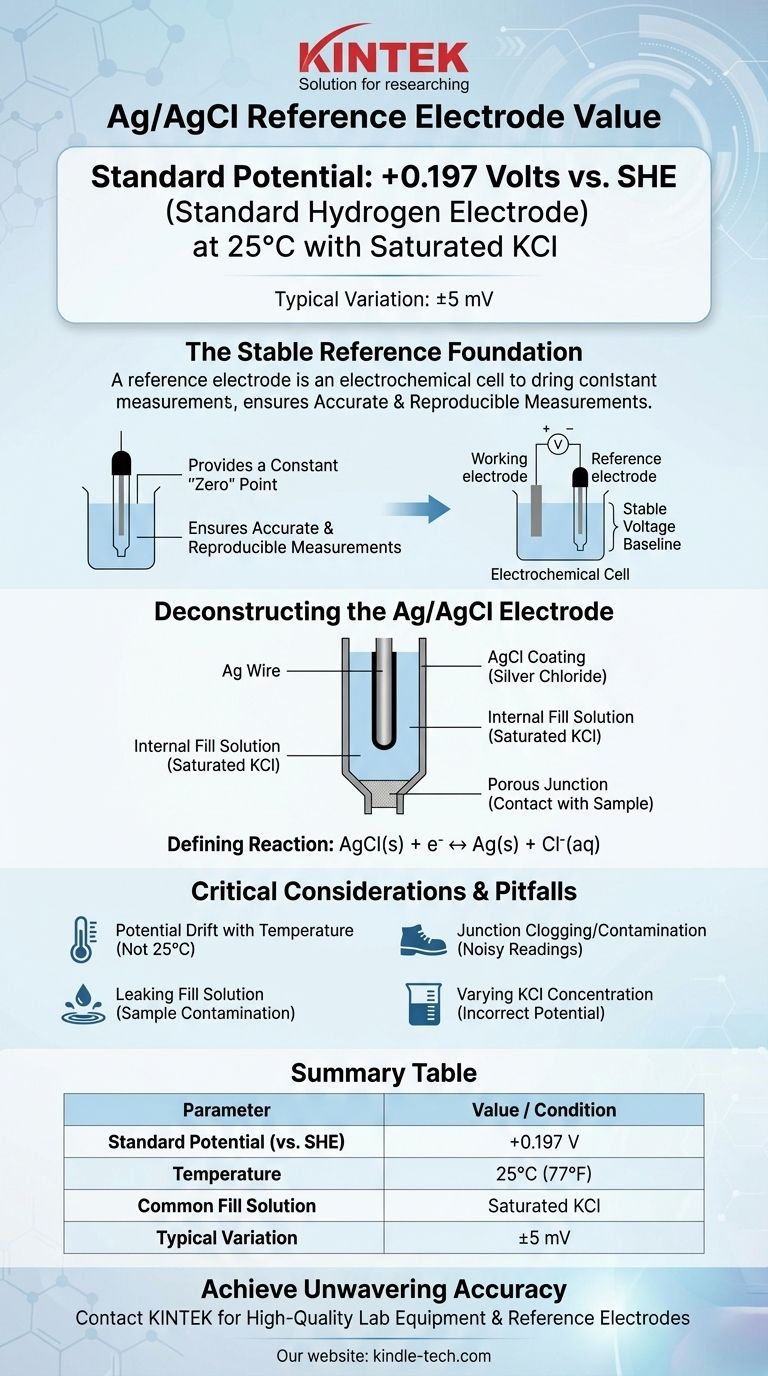
Nella sua configurazione più comune, l'elettrodo di riferimento argento/cloruro d'argento (Ag/AgCl) ha un potenziale di +0,197 Volt rispetto all'Elettrodo a Idrogeno Standard (SHE) a 25°C. Questo valore presuppone che l'elettrodo utilizzi una soluzione di riempimento di cloruro di potassio (KCl) saturo. Variazioni minori, spesso citate come +199 mV (±5mV), sono comuni a causa di leggere differenze nella preparazione e nelle condizioni.
La funzione principale di un elettrodo di riferimento è quella di fornire una linea di base di tensione stabile e costante. Comprendere che il potenziale dell'elettrodo Ag/AgCl è definito da un equilibrio chimico specifico ed è sensibile alla concentrazione di cloruro e alla temperatura, è la chiave per utilizzarlo per misurazioni accurate e riproducibili.

Il Ruolo di un Riferimento Stabile
Stabilire un Punto Zero
Tutte le misurazioni di tensione sono intrinsecamente una differenza di potenziale tra due punti. In elettrochimica, non è possibile misurare il potenziale assoluto di un singolo elettrodo di lavoro.
Un elettrodo di riferimento fornisce un potenziale costante e noto che funge da punto "zero" stabile. Tutti gli altri potenziali nella vostra cella elettrochimica vengono quindi misurati rispetto a questo riferimento costante.
Come Raggiunge la Stabilità
Un elettrodo di riferimento ideale è descritto come "ben equilibrato" (well-poised). Ciò significa che il suo potenziale è governato da una reazione chimica veloce e reversibile che non viene significativamente disturbata dalla piccola quantità di corrente che fluisce durante la misurazione.
Per l'elettrodo Ag/AgCl, questa stabilità deriva dall'equilibrio tra il cloruro d'argento solido e gli ioni argento e cloruro.
Decomporre l'Elettrodo Ag/AgCl
I Componenti Principali
Un tipico elettrodo Ag/AgCl è costituito da un filo d'argento (Ag) che è stato rivestito con uno strato di cloruro d'argento solido (AgCl).
Questo intero assemblaggio è immerso in una soluzione di riempimento interna che contiene una concentrazione nota e fissa di ioni cloruro (Cl⁻), più comunemente cloruro di potassio (KCl). Una giunzione porosa, spesso fatta di ceramica o cotone, consente il contatto elettrico con la soluzione del campione.
La Reazione Elettrochimica Definitiva
Il potenziale dell'elettrodo è stabilito da una reazione di semi-cella semplice e reversibile:
AgCl(s) + e⁻ ↔ Ag(s) + Cl⁻(aq)
Il potenziale di questo equilibrio dipende direttamente dall'attività (effettivamente, la concentrazione) degli ioni cloruro nella soluzione di riempimento.
Perché la Soluzione di Riempimento è Critica
Poiché il potenziale dipende dalla concentrazione di cloruro, il suo valore deve essere fisso e noto.
Il KCl saturo è la scelta più comune perché è facile da preparare e mantenere. Finché sono presenti cristalli solidi di KCl, la soluzione rimane satura, garantendo un'attività di cloruro costante e quindi un potenziale stabile di +0,197 V.
Vengono utilizzate anche altre concentrazioni, come 3M o 1M KCl, e daranno luogo a potenziali di riferimento diversi.
Comprendere i Compromessi e le Insidie
Deriva del Potenziale con la Temperatura
Il potenziale standard di +0,197 V è valido solo a 25°C (77°F). Il potenziale dell'elettrodo cambierà in modo prevedibile con la temperatura. Per lavori di alta precisione, questa dipendenza dalla temperatura deve essere considerata o controllata.
Intasamento e Contaminazione della Giunzione
La giunzione porosa è il punto di guasto più comune. Se si intasa con materiale del campione o se l'elettrolita interno cristallizza al suo interno, la connessione elettrica si interrompe, portando a letture rumorose o completamente instabili.
Perdita della Soluzione di Riempimento
La soluzione di riempimento interna fuoriesce lentamente attraverso la giunzione per design. Se il vostro campione è sensibile agli ioni cloruro o potassio, questa perdita può causare contaminazione o reazioni collaterali indesiderate, interferendo con la vostra misurazione. In questi casi, potrebbe essere necessario un elettrodo a doppia giunzione con un elettrolita esterno diverso.
Assumere KCl Saturo
Non assumete mai che il vostro elettrodo Ag/AgCl utilizzi una soluzione di KCl saturo. Verificate sempre la concentrazione della soluzione di riempimento, poiché l'utilizzo del potenziale di riferimento sbagliato nei vostri calcoli è una fonte fondamentale di errore. Un elettrodo con 3M KCl, ad esempio, ha un potenziale più vicino a +0,210 V vs. SHE.
Fare la Scelta Giusta per il Vostro Obiettivo
Per garantire che le vostre misurazioni siano valide, dovete trattare il vostro elettrodo di riferimento come lo strumento critico che è.
- Se il vostro obiettivo principale è l'analisi di routine (es. misurazione del pH): Utilizzate un elettrodo commerciale sigillato, conservatelo correttamente nella sua soluzione di conservazione designata per mantenere la giunzione umida e sostituitelo quando le letture diventano instabili.
- Se il vostro obiettivo principale è la ricerca di alta precisione (es. studi sulla corrosione): Riportate sempre l'elettrodo di riferimento specifico utilizzato (es. Ag/AgCl, KCl sat.) insieme ai vostri dati, monitorate la deriva e considerate la calibrazione rispetto a uno standard preparato di fresco.
- Se il vostro obiettivo principale è evitare la contaminazione del campione: Selezionate un elettrodo a doppia giunzione o uno con una soluzione di riempimento chimicamente compatibile con il vostro campione per prevenire precipitazioni o interferenze alla giunzione liquida.
Un elettrodo di riferimento affidabile è la base di qualsiasi misurazione elettrochimica accurata.
Tabella Riepilogativa:
| Parametro | Valore / Condizione |
|---|---|
| Potenziale Standard (vs. SHE) | +0.197 V |
| Temperatura | 25°C (77°F) |
| Soluzione di Riempimento Comune | KCl saturo |
| Variazione Tipica | ±5 mV |
Raggiungete un'Accuratezza Inalterabile nel Vostro Laboratorio
Le vostre misurazioni elettrochimiche sono affidabili solo quanto il vostro elettrodo di riferimento. KINTEK è specializzata in attrezzature e materiali di consumo da laboratorio di alta qualità, fornendo gli elettrodi di riferimento Ag/AgCl precisi e stabili di cui il vostro laboratorio ha bisogno per risultati riproducibili.
Lasciate che i nostri esperti vi aiutino a selezionare l'elettrodo di riferimento perfetto per la vostra applicazione, sia che si tratti di analisi di routine o di ricerca di alta precisione.
Contattate KINTEK oggi stesso per assicurarvi che le vostre misurazioni siano costruite su solide basi.
Guida Visiva
Prodotti correlati
- Elettrodo a disco rotante in platino per applicazioni elettrochimiche
- Elettrodo di riferimento al solfato di rame per uso di laboratorio
- Elettrodo a disco d'oro
- Elettrodo Ausiliario in Platino per Uso di Laboratorio
- Elettrodo a disco rotante (anello-disco) RRDE / compatibile con PINE, ALS giapponese, Metrohm svizzero al carbonio vetroso platino
Domande frequenti
- Qual è la manutenzione ordinaria richiesta per un foglio RVC? Una guida per preservare le prestazioni degli elettrodi
- Perché un'asta di grafite porosa viene selezionata come elettrodo di contro per testare elettrodi di carta di carbonio modificati?
- Cosa rende il titanio e l'acciaio inossidabile substrati adatti per catalizzatori a base di nichel? Sbloccare prestazioni ed economia
- Qual è la conducibilità termica della grafite a temperatura ambiente? Una guida alla sua natura anisotropa
- Quale funzione svolge un catodo di acciaio inossidabile nel recupero dei PGM? Ruolo chiave nell'elettrodeposizione efficiente dei metalli
- Cos'è il metodo dell'elettrodo a disco ad anello rotante? Sblocca l'analisi delle reazioni in tempo reale
- Qual è la procedura di post-trattamento corretta per un elettrodo a lamina di platino? Garantisci accuratezza a lungo termine e proteggi il tuo investimento
- Ruoli degli elettrodi di contro-bilanciamento in platino vs. elettrodi di riferimento Ag/AgCl nei sistemi a 3 elettrodi



















