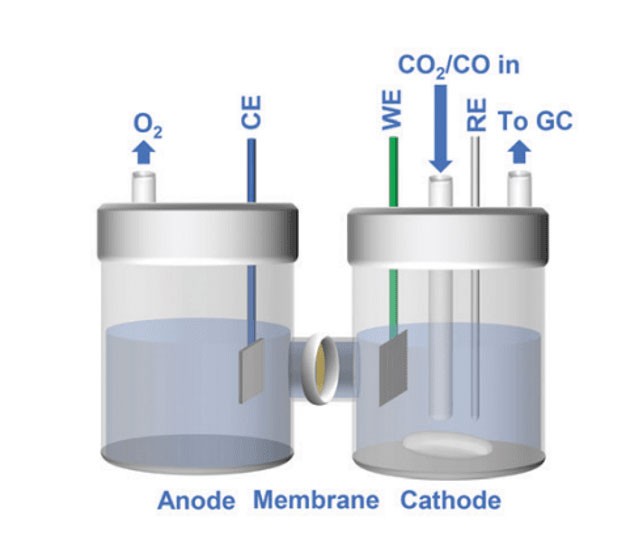
Introduzione alle celle elettrolitiche al quarzo
Le celle elettrolitiche al quarzo sono fondamentali per trasformare l'energia elettrica in energia chimica, svolgendo un ruolo cruciale in vari processi industriali. Queste celle sono caratterizzate dall'uso del quarzo come materiale chiave, che non solo resiste alle alte temperature ma mantiene anche l'inerzia chimica. Le celle elettrolitiche al quarzo sono costituite da elettrodi ed elettroliti, che insieme facilitano precise reazioni di ossidazione e riduzione. Questa introduzione pone le basi per un'esplorazione più approfondita dei meccanismi, delle applicazioni e dei vantaggi delle celle elettrolitiche al quarzo, evidenziandone l'importanza in settori che vanno dalla produzione di metalli alla farmaceutica.
Meccanismo di azione delle celle elettrolitiche al quarzo
Le celle elettrolitiche al quarzo sono dispositivi specializzati utilizzati in vari processi industriali, in particolare nell'elettroraffinazione e nell'elettrofiltrazione di metalli non ferrosi come alluminio, rame, zinco e piombo. Queste celle sono progettate per facilitare la migrazione degli ioni e la conduzione efficiente delle reazioni di ossidazione e riduzione attraverso l'uso di una struttura di quarzo e di un mezzo elettrolitico accuratamente scelto.
Migrazione degli ioni e ruolo degli elettrodi
In una cella elettrolitica al quarzo, il processo inizia quando al sistema viene applicata una tensione esterna. Questa tensione determina la migrazione degli ioni all'interno dell'elettrolita. Gli ioni positivi, o cationi, sono attratti dal catodo con carica negativa, mentre gli ioni negativi, o anioni, si muovono verso l'anodo con carica positiva. Questo movimento di ioni è fondamentale per la conduzione dell'elettricità e l'avvio delle reazioni chimiche.
Al catodo avvengono le reazioni di riduzione. Qui i cationi guadagnano elettroni e si depositano sulla superficie del catodo. Ad esempio, nell'elettroraffinazione del rame, gli ioni di rame (Cu²⁺) guadagnano elettroni per formare rame metallico puro, che viene poi depositato sul catodo. Questo processo è essenziale per ottenere metalli di elevata purezza utilizzati in varie applicazioni industriali.
Al contrario, all'anodo avvengono reazioni di ossidazione. Gli anioni perdono elettroni e rilasciano altri ioni o molecole. Nel caso dell'elettroraffinazione del rame, l'anodo è costituito da rame impuro. Quando il rame si scioglie, rilascia impurità nell'elettrolita, che vengono poi rimosse, lasciando il rame puro al catodo.

Importanza del mezzo elettrolitico
Il mezzo elettrolitico in una cella elettrolitica al quarzo svolge un ruolo fondamentale per l'efficienza e l'efficacia delle reazioni. L'elettrolita deve essere un buon conduttore di ioni e deve essere stabile nelle condizioni della reazione. Gli elettroliti più comuni includono soluzioni acquose di sali, acidi o basi, nonché sali fusi.
La scelta dell'elettrolita dipende dai requisiti specifici della reazione, come il pH desiderato, la concentrazione di ioni e la temperatura a cui avviene la reazione. Ad esempio, nella produzione di alluminio di elevata purezza, come elettrolita si utilizza una miscela fusa di criolite (Na₃AlF₆) e allumina (Al₂O₃). Questa miscela ha un basso punto di fusione ed è altamente conduttiva, il che la rende ideale per la riduzione elettrolitica dell'allumina in alluminio.
La struttura del quarzo e i suoi vantaggi
L'uso del quarzo nelle celle elettrolitiche offre diversi vantaggi. Il quarzo è un eccellente isolante, che contribuisce a mantenere l'integrità del campo elettrico all'interno della cella. Inoltre, il quarzo è resistente alla corrosione chimica, assicurando che la cella possa funzionare in condizioni difficili senza deteriorarsi.
La struttura del quarzo consente anche un controllo preciso della distribuzione degli ioni e del flusso di elettricità. Questa precisione è fondamentale per ottimizzare l'efficienza delle reazioni e ridurre al minimo le perdite di energia. Inoltre, la trasparenza del quarzo consente di monitorare visivamente le reazioni, a vantaggio del controllo del processo e della risoluzione dei problemi.
Applicazioni nella purificazione dei metalli e nella galvanotecnica
Le celle elettrolitiche al quarzo sono ampiamente utilizzate nella purificazione dei metalli e nei processi galvanici. Nella purificazione dei metalli, come l'elettrodeposizione del rame, il metallo impuro viene utilizzato come anodo e il metallo puro viene depositato sul catodo. Questo processo rimuove le impurità e produce un metallo di elevata purezza adatto a varie applicazioni industriali.
Nella galvanotecnica, le celle elettrolitiche al quarzo vengono utilizzate per depositare uno strato sottile del metallo desiderato su un substrato. Questo processo migliora le proprietà del substrato, come l'aspetto, la durata e la resistenza alla corrosione. La galvanica è comunemente utilizzata nell'industria automobilistica, aerospaziale ed elettronica.
Conclusione
In sintesi, le celle elettrolitiche al quarzo sono strumenti essenziali nella produzione di metalli di elevata purezza e in vari processi elettrochimici. Il loro meccanismo d'azione coinvolge la migrazione degli ioni, il ruolo degli elettrodi nel facilitare le reazioni di ossidazione e riduzione e l'importanza del mezzo elettrolitico. L'uso del quarzo offre diversi vantaggi, tra cui l'isolamento, la resistenza alla corrosione e il controllo preciso delle reazioni. Queste celle sono ampiamente utilizzate per la purificazione e la galvanizzazione dei metalli, contribuendo al progresso di varie applicazioni industriali.
Applicazioni delle celle elettrolitiche al quarzo
Le celle elettrolitiche al quarzo svolgono un ruolo cruciale in diverse applicazioni industriali, in particolare nella produzione di metalli di elevata purezza, nell'elettrolisi dell'acqua e nell'industria farmaceutica. Queste celle sono progettate per resistere alle alte temperature e agli ambienti corrosivi e sono quindi ideali per i processi che richiedono precisione e affidabilità.
Produzione di metalli di elevata purezza
Una delle applicazioni principali delle celle elettrolitiche al quarzo è la produzione di metalli di elevata purezza, come alluminio e rame. Il processo elettrolitico prevede l'uso di una corrente continua per pilotare una reazione chimica non spontanea. Nel caso della produzione di alluminio, la materia prima, la bauxite, viene sciolta in un bagno di criolite fusa. Gli ioni di alluminio vengono poi ridotti al catodo, dando luogo alla deposizione di alluminio puro. Questo processo richiede molta energia, ma garantisce un livello di purezza fino al 99,99%.
Allo stesso modo, il rame di elevata purezza viene prodotto attraverso un processo noto come elettroraffinazione. In questo processo, il rame impuro viene utilizzato come anodo e, quando la corrente passa attraverso la cella elettrolitica, gli ioni di rame puro si depositano sul catodo. Le impurità rimangono nell'elettrolita o formano un fango separato sul fondo della cella, garantendo la purezza del prodotto finale.
Elettrolisi dell'acqua
Le celle elettrolitiche al quarzo sono ampiamente utilizzate anche nell'elettrolisi dell'acqua, un processo che scinde l'acqua nei suoi elementi costitutivi, idrogeno e ossigeno. Questo processo è particolarmente utile nelle industrie che richiedono grandi quantità di questi gas, come l'industria chimica e farmaceutica. L'elettrolisi dell'acqua comporta il passaggio di una corrente elettrica attraverso l'acqua contenente ioni disciolti (in genere da un sale o da un acido). Gli ioni idrogeno (H+) migrano verso il catodo, dove vengono ridotti a idrogeno gassoso, mentre gli ioni idrossido (OH-) migrano verso l'anodo, dove vengono ossidati a ossigeno gassoso.

Industria farmaceutica
Nell'industria farmaceutica, le celle elettrolitiche al quarzo sono utilizzate per la produzione di vari prodotti e composti chimici. Ad esempio, l'elettrolisi di una soluzione di cloruro di sodio (salamoia) viene utilizzata per produrre cloro gassoso e idrossido di sodio (soda caustica), entrambi materie prime essenziali per la sintesi di molti prodotti farmaceutici. Il controllo preciso del processo elettrolitico fornito dalle celle al quarzo assicura l'elevata purezza e consistenza di queste sostanze chimiche, fondamentali per le applicazioni farmaceutiche.
Galvanotecnica e trattamento delle superfici
Un'altra applicazione significativa delle celle elettrolitiche al quarzo è quella dei processi di galvanotecnica e di trattamento delle superfici. La galvanoplastica consiste nel depositare un sottile strato di un metallo specifico sulla superficie di un altro metallo per migliorarne le proprietà, come la resistenza alla corrosione, all'usura o l'estetica. Le celle al quarzo forniscono un ambiente stabile e controllato per questi processi, garantendo rivestimenti uniformi e di alta qualità.
Consumo energetico ed efficienza
Il consumo di energia nei processi elettrolitici varia a seconda del metallo prodotto. Ad esempio, la produzione elettrolitica di alluminio richiede circa 13-15 kWh di elettricità per chilogrammo di metallo. La raffinazione del rame mediante elettrolisi, invece, consuma da 150 a 300 kWh per tonnellata di rame raffinato. Nonostante l'elevato fabbisogno energetico, l'efficienza e la purezza dei prodotti finali rendono questi processi indispensabili nell'industria moderna.
In conclusione, le celle elettrolitiche al quarzo sono fondamentali in diversi settori industriali, offrendo un controllo preciso e un'elevata efficienza nella produzione di metalli di elevata purezza, nell'elettrolisi dell'acqua e nei prodotti chimici farmaceutici. La loro capacità di operare in ambienti difficili e la loro durata ne fanno uno strumento essenziale nelle moderne industrie di produzione e lavorazione.
Vantaggi dell'uso del quarzo nelle celle elettrolitiche
Il quarzo, una forma di silice (SiO2), è noto per le sue proprietà uniche che lo rendono un materiale ideale da utilizzare nelle celle elettrolitiche. Queste celle sono fondamentali in vari processi industriali, tra cui la produzione di sostanze chimiche, metalli e semiconduttori. La scelta del quarzo rispetto ad altri materiali come il vetro è dovuta principalmente alla sua superiore resistenza alle alte temperature, all'inerzia chimica e alle eccellenti proprietà elettriche.
Resistenza alle alte temperature
Il quarzo può resistere a temperature fino a 1100°C, molto più elevate rispetto al vetro, che si ammorbidisce intorno ai 700°C. Questa resistenza alle alte temperature è fondamentale nelle celle elettrolitiche, dove le temperature possono aumentare notevolmente a causa delle correnti elettriche e delle reazioni chimiche coinvolte. La capacità del quarzo di mantenere la propria integrità strutturale in queste condizioni garantisce la longevità e l'efficienza del processo elettrolitico.
Inerzia chimica
Il quarzo è altamente resistente alla maggior parte delle sostanze chimiche, compresi acidi, alcali e sali. Questa inerzia chimica è particolarmente vantaggiosa nelle celle elettrolitiche, dove l'ambiente è spesso altamente corrosivo a causa degli elettroliti utilizzati. Utilizzando il quarzo, il rischio di reazioni chimiche che potrebbero degradare i componenti della cella è ridotto al minimo, migliorando così la durata e le prestazioni della cella.

Proprietà elettriche
A differenza del vetro, che è un buon isolante, il quarzo è un eccellente conduttore di elettricità. Questa proprietà è fondamentale nelle celle elettrolitiche, dove la conduzione efficiente dell'elettricità è essenziale perché il processo elettrolitico avvenga in modo efficace. L'elevata rigidità dielettrica e la bassa perdita elettrica del quarzo lo rendono un materiale ideale per gli elettrodi e gli altri componenti elettrici della cella.
Purezza e trasparenza
Il quarzo è altamente puro, con un contenuto di SiO2 di almeno il 99,9%. Questa elevata purezza è essenziale in settori come la produzione di semiconduttori, dove anche tracce di impurità possono influire negativamente sul processo. La trasparenza del quarzo dallo spettro ultravioletto a quello infrarosso consente inoltre un migliore monitoraggio e controllo del processo elettrolitico, garantendo risultati di qualità superiore.
Proprietà meccaniche e ottiche
Il quarzo presenta eccezionali proprietà meccaniche, tra cui elevata rigidità, elasticità e resistenza agli urti. Queste proprietà assicurano che i componenti in quarzo possano sopportare le sollecitazioni meccaniche incontrate nelle celle elettrolitiche senza compromettere la loro integrità strutturale. Inoltre, le eccellenti proprietà di trasmissione ottica del quarzo consentono un monitoraggio e una regolazione precisi del processo elettrolitico, contribuendo a una maggiore efficienza e accuratezza.
Applicazioni nelle celle elettrolitiche
Le proprietà uniche del quarzo lo rendono adatto a un'ampia gamma di applicazioni nelle celle elettrolitiche. I tubi e le barre di quarzo, ad esempio, sono utilizzati nella produzione di semiconduttori per la pulizia dei bagni dopo l'incisione e la lavorazione e nei tubi sottoposti a trattamenti termici. Nei laboratori, il quarzo è utilizzato per i calibri a vista, nell'ottica e in vari processi industriali, dove la sua resistenza agli urti e l'inerzia chimica sono preziose.
In conclusione, l'uso del quarzo nelle celle elettrolitiche sfrutta le sue proprietà superiori, tra cui la resistenza alle alte temperature, l'inerzia chimica, le eccellenti proprietà elettriche e i vantaggi meccanici e ottici. Queste caratteristiche non solo migliorano le prestazioni e la durata delle celle elettrolitiche, ma contribuiscono anche alla produzione di risultati di alta qualità in varie applicazioni industriali.
Confronto con altri tipi di celle elettrolitiche
Le celle elettrolitiche sono un tipo fondamentale di cella elettrochimica, che differisce notevolmente dalle celle galvaniche per quanto riguarda la configurazione, il funzionamento e gli usi tipici. La comprensione di queste differenze è fondamentale per la scelta del tipo di cella più adatto ad applicazioni specifiche nella ricerca e nell'industria.
Differenze chiave tra celle elettrolitiche e galvaniche
-
Conversione di energia:
- Celle galvaniche: Queste celle convertono spontaneamente l'energia chimica in energia elettrica. Sono azionate da reazioni redox che si verificano naturalmente, producendo un flusso di elettroni dall'anodo al catodo attraverso un circuito esterno. Ne sono un esempio le batterie e le celle a combustibile.
- Celle elettrolitiche: Le celle elettrolitiche, invece, richiedono una fonte di energia elettrica esterna per attivare reazioni chimiche non spontanee. Sono utilizzate in processi come l'elettrolisi, dove l'energia elettrica viene utilizzata per decomporre i composti o per guidare le reazioni nella direzione desiderata.
-
Spontaneità delle reazioni:
- Celle galvaniche: Le reazioni nelle celle galvaniche sono spontanee, cioè avvengono senza bisogno di una fonte di energia esterna una volta che la cella è stata impostata.
- Celle elettrolitiche: Le reazioni nelle celle elettrolitiche non sono spontanee e richiedono l'immissione di energia elettrica per procedere.
-
Polarità degli elettrodi:
- Celle galvaniche: Nelle celle galvaniche, l'anodo è l'elettrodo negativo dove avviene l'ossidazione e il catodo è l'elettrodo positivo dove avviene la riduzione.
- Celle elettrolitiche: Nelle celle elettrolitiche le polarità sono invertite. L'anodo è positivo e il catodo è negativo, il che riflette la necessità di una fonte di energia esterna per forzare gli elettroni contro il loro flusso naturale.

Usi tipici delle celle elettrolitiche e galvaniche
- Celle galvaniche: Comunemente utilizzate in dispositivi di uso quotidiano come batterie (ad esempio, alcaline, agli ioni di litio), celle a combustibile e celle solari. Sono essenziali per i dispositivi elettronici portatili, in quanto forniscono una fonte affidabile di energia elettrica attraverso reazioni chimiche spontanee.
- Celle elettrolitiche: Utilizzate in processi industriali come la galvanoplastica (rivestimento di un metallo su un altro), l'elettrolisi dell'acqua (produzione di idrogeno e ossigeno) e la raffinazione dei metalli (ad esempio, la raffinazione del rame). Sono inoltre fondamentali per la produzione di sostanze chimiche come l'idrossido di sodio e il cloro attraverso l'elettrolisi della salamoia.
Differenze strutturali
- Celle galvaniche: In genere sono costituite da due diverse soluzioni elettrolitiche in contenitori separati, collegate da un ponte di sale per mantenere la neutralità elettrica. Gli elettrodi (anodo e catodo) sono immersi in queste soluzioni e un circuito esterno permette il flusso di elettroni.
- Celle elettrolitiche: Spesso hanno una struttura più semplice con entrambi gli elettrodi immersi in un'unica soluzione elettrolitica. La fonte di alimentazione esterna è collegata agli elettrodi per pilotare il processo elettrolitico.
Conclusione
Sebbene sia le celle elettrolitiche che quelle galvaniche siano tipi di celle elettrochimiche e comportino reazioni redox, esse servono a scopi fondamentalmente diversi a causa della natura delle loro reazioni e delle conversioni di energia che facilitano. La comprensione di queste differenze aiuta a scegliere il tipo di cella più adatto per applicazioni specifiche, sia che si tratti di generare energia elettrica spontaneamente, sia che si tratti di pilotare reazioni chimiche attraverso l'immissione di energia elettrica.
Conclusione
In conclusione,le celle elettrolitiche al quarzo si distinguono come componenti critici nei moderni processi industriali, sfruttando le loro proprietà uniche per facilitare reazioni chimiche precise e la produzione di metalli di elevata purezza. La loro capacità di resistere alle alte temperature e l'inerzia chimica le posizionano come alternative superiori in varie applicazioni, dall'elettrolisi dell'acqua alla produzione farmaceutica. Nonostante le sfide, come la manutenzione e il degrado degli elettrodi, la ricerca in corso promette innovazioni che ne miglioreranno l'efficienza e ne amplieranno l'utilità. Con la continua evoluzione delle industrie, il ruolo delle celle elettrolitiche al quarzo crescerà senza dubbio, sottolineando la loro importanza nel progresso dei processi tecnologici e chimici.
Prodotti correlati
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrolitica Elettrochimica Ottica a Finestra Laterale
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Bagno d'acqua per cella elettrochimica elettrolitica multifunzionale a strato singolo e doppio
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
Articoli correlati
- L'Architettura della Precisione: Perché i Dettagli Invisibili Definiscono il Successo Elettrochimico
- La Variabile Invisibile: Perché i Rituali Post-Esperimento Definiscono la Verità Scientifica
- Il Cuore di Vetro: Perché la Buona Scienza Muore in Celle Sporche
- Il Recipiente della Verità: Perché il Contenitore Conta Più della Chimica
- Il Cuore di Vetro dell'Esperimento: Precisione Attraverso la Cura Sistematica