Criteri di progettazione delle celle elettrolitiche
Volume della cella elettrolitica
Il volume di una cella elettrolitica gioca un ruolo fondamentale nel determinare l'efficienza e la precisione dei processi elettrochimici. Il volume ottimale della cella dipende dal mantenimento di un rapporto appropriato tra l'elettrodo di lavoro e il volume della soluzione. Questo rapporto non è statico, ma varia in modo significativo in base al tipo specifico di misura o test che si sta conducendo.
Ad esempio, nelle misure analitiche di alta precisione, spesso si preferisce un volume di cella più piccolo con un rapporto elettrodo-soluzione più elevato. Questa configurazione riduce al minimo lo spessore dello strato di diffusione, migliorando così la sensibilità e l'accuratezza delle letture. Al contrario, nelle applicazioni industriali che prevedono la produzione di metalli su larga scala, potrebbe essere necessario un volume di cella più grande con un rapporto elettrodo-soluzione più basso, per far fronte all'aumento della produttività e delle esigenze operative.
| Tipo di misura | Volume di cella preferito | Rapporto elettrodo-soluzione |
|---|---|---|
| Analisi di alta precisione | Piccolo | Alto (ad es. 1:10) |
| Produzione industriale di metalli | Grande | Basso (ad es., 1:100) |
La comprensione e l'ottimizzazione di questo rapporto è fondamentale per ottenere i risultati desiderati in varie applicazioni elettrochimiche.
Materiale delle celle elettrolitiche
Nella scelta dei materiali per le celle elettrolitiche, si distinguono due opzioni principali: il vetro e il politetrafluoroetilene (PTFE). Ogni materiale presenta una serie di vantaggi e limitazioni che devono essere attentamente considerati in base all'applicazione specifica e alle condizioni ambientali.
Il PTFE, in particolare, è rinomato per la sua eccezionale stabilità, soprattutto in ambienti difficili come gli alcali concentrati e l'acqua regia. Questa stabilità è fondamentale per mantenere l'integrità e l'efficienza del processo elettrolitico, soprattutto in ambienti industriali in cui l'esposizione prolungata a sostanze corrosive è inevitabile. La natura inerte del PTFE garantisce che non reagisca con l'elettrolita o con altri componenti della cella, riducendo così al minimo le potenziali interruzioni e prolungando la durata operativa della cella.
D'altra parte, il vetro offre i suoi vantaggi, in particolare nelle applicazioni in cui la trasparenza è essenziale per il monitoraggio del processo elettrolitico. Tuttavia, la sua suscettibilità alla corrosione in ambienti fortemente alcalini ne limita l'uso in alcuni contesti. Nonostante ciò, il vetro rimane una scelta popolare per gli esperimenti su scala di laboratorio e le dimostrazioni didattiche, grazie alla sua economicità e facilità di fabbricazione.

In sintesi, la scelta tra vetro e PTFE dipende dai requisiti specifici del processo elettrolitico, tra cui l'ambiente chimico, la longevità operativa e le considerazioni sui costi.
Diaframma per cella elettrolitica
Il diaframma di una cella elettrolitica svolge una funzione critica nel separare l'elettrodo di lavoro dall'elettrodo ausiliario. Uno dei materiali più comunemente utilizzati a questo scopo è il vetro poroso. Questa scelta non è arbitraria: il vetro poroso offre diversi vantaggi che migliorano le prestazioni e la precisione del processo elettrolitico.
In primo luogo, il vetro poroso garantisce distribuzione uniforme della corrente distribuzione uniforme della corrente in tutta la cella. Questa uniformità è essenziale per mantenere misure coerenti e affidabili. Fornendo un percorso coerente per il flusso di corrente, il vetro poroso aiuta a ridurre al minimo le fluttuazioni e gli errori nei dati raccolti.
In secondo luogo, l'uso del vetro poroso come diaframma riduce le interferenze dall'elettrodo ausiliario. Nelle celle elettrolitiche, i prodotti generati sull'elettrodo ausiliario possono talvolta diffondersi nell'ambiente dell'elettrodo di lavoro, causando reazioni indesiderate e alterando i risultati. I pori sottili del vetro fungono da barriera, impedendo questa contaminazione incrociata e preservando l'integrità dell'ambiente dell'elettrodo di lavoro.
Inoltre, il vetro poroso è altamente resistente agli attacchi chimici, rendendolo adatto all'uso in e ciò lo rende adatto all'uso in una varietà di soluzioni elettrolitiche. Questa stabilità chimica garantisce che il diaframma rimanga efficace per lunghi periodi, anche in condizioni difficili.
In sintesi, la scelta del vetro poroso come materiale per i diaframmi è dettata dalla sua capacità di fornire una distribuzione uniforme della corrente, di ridurre le interferenze e di mantenere la stabilità chimica, tutti fattori cruciali per un funzionamento preciso e affidabile delle celle elettrolitiche.
Elettroliti
Gli elettroliti inerti svolgono un ruolo fondamentale nella progettazione delle celle elettrolitiche, soprattutto per evitare la migrazione di sostanze attive che potrebbero interferire con le reazioni chimiche previste. La concentrazione di questi elettroliti inerti deve essere significativamente superiore a quella delle sostanze attive per garantirne l'efficacia. In genere, la concentrazione deve essere almeno 100 volte superiore a quella del principio attivo. Questa elevata concentrazione funge da barriera, riducendo al minimo il potenziale di contaminazione incrociata e garantendo la stabilità e l'affidabilità del processo elettrolitico.
Ad esempio, nella produzione industriale di metalli, dove il controllo preciso delle reazioni chimiche è fondamentale, l'uso di elettroliti inerti assicura che le reazioni primarie non siano compromesse dalla presenza di altre specie reattive. Questo elevato rapporto di concentrazione non solo stabilizza l'ambiente elettrolitico, ma migliora anche l'efficienza del processo, riducendo la probabilità di reazioni collaterali indesiderate. Pertanto, l'attenta selezione e la gestione degli elettroliti inerti sono componenti essenziali nella progettazione e nel funzionamento delle celle elettrolitiche.
Dispositivo di sfiato della cella elettrolitica
I canali di ingresso e di uscita sono componenti essenziali di una cella elettrolitica, progettati per facilitare i processi di deossigenazione e di adsorbimento dei gas. La configurazione di questi canali è fondamentale per mantenere l'efficienza e la sicurezza del processo elettrolitico. In genere, l'ingresso è posizionato strategicamente sul fondo della cella, in modo da garantire che il gas in ingresso sia distribuito uniformemente nell'elettrolita. Questo posizionamento sul fondo favorisce la miscelazione completa dei gas con l'elettrolita, promuovendo un'efficace deossigenazione.
L'uscita, invece, è dotata di un meccanismo di tenuta ad acqua. La tenuta ad acqua ha molteplici funzioni: impedisce il riflusso del gas dall'uscita, assicura un rilascio controllato dei gas e mantiene una pressione stabile all'interno della cella. Grazie alla tenuta ad acqua, la cella elettrolitica può funzionare in condizioni ottimali, riducendo il rischio di perdite di gas e garantendo che l'ambiente all'interno della cella rimanga stabile e favorevole al processo elettrolitico.
In sintesi, un'attenta progettazione dei canali di ingresso e di uscita, con l'ingresso in basso e l'uscita dotata di una guarnizione ad acqua, è fondamentale per un'efficace deossigenazione e adsorbimento dei gas nelle celle elettrolitiche, migliorando così l'efficienza complessiva e la sicurezza del processo.
Ponte salino per cella elettrolitica
Il ponte salino è un componente essenziale delle celle elettrolitiche, in quanto funge da condotto di collegamento tra l'elettrodo di riferimento e quello di ricerca. Questo collegamento è fondamentale per mantenere la neutralità elettrica all'interno della cella, facilitando così il flusso regolare degli ioni e completando il circuito elettrico. Il ponte salino è tipicamente composto da un elettrolita forte, come il cloruro di sodio o il nitrato di potassio, che viene alloggiato in un tubo di vetro a forma di U o immerso in materiali porosi come la carta da filtro.
Una delle funzioni principali del ponte salino è quella di attenuare il potenziale di contatto del liquido, un fenomeno che si verifica quando due elettroliti diversi entrano in contatto, generando una differenza di potenziale. Assicurando che la soluzione elettrolitica nel ponte salino sia inerte e non reattiva con altre soluzioni, si riduce al minimo il rischio di reazioni chimiche indesiderate. Questa inerzia consente il movimento senza ostacoli degli ioni tra le due semicelle, mantenendo una distribuzione di carica stabile e prevenendo la contaminazione.
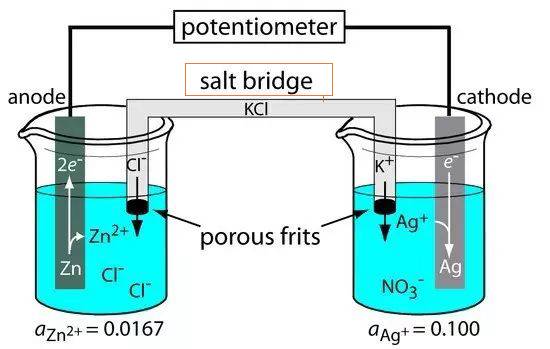
Esistono due tipi comuni di ponti salini: il ponte in tubo di vetro e il ponte in carta da filtro. Il ponte a tubo di vetro, come suggerisce il nome, è un tubo a forma di U riempito di elettroliti, mentre il ponte a carta da filtro utilizza carta da filtro porosa imbevuta di soluzioni elettrolitiche. Entrambi i tipi hanno lo stesso scopo, ma si differenziano per la struttura fisica e la facilità d'uso.
Nelle applicazioni pratiche, come la costruzione di celle galvaniche o voltaiche, il ponte salino svolge un ruolo fondamentale. Quando gli elettroni passano da una semicella all'altra attraverso un circuito esterno, si stabilisce una differenza di carica. Senza il ponte salino, questa differenza di carica arresterebbe rapidamente il flusso di elettroni. Il ponte salino consente il movimento continuo degli ioni, assicurando che la distribuzione della carica rimanga stabile e che la cella funzioni in modo efficiente.
In sintesi, il ponte salino è un elemento critico nelle celle elettrolitiche, in quanto consente un flusso continuo di ioni e mantiene la neutralità elettrica. Il suo design e la sua composizione sono scelti con cura per evitare reazioni indesiderate e garantire l'integrità del processo elettrochimico.
Tubo capillare Rukin per cella elettrolitica
Il tubo capillare Rukin svolge un ruolo fondamentale nella progettazione delle celle elettrolitiche, in particolare nel mantenere una resistenza minima tra l'elettrodo di riferimento e quello di lavoro. Questa caratteristica critica è essenziale per ottenere un controllo preciso del potenziale, fondamentale per l'accuratezza e l'affidabilità dei processi elettrolitici.
Funzioni chiave del tubo capillare Rukin
-
Resistenza minima: La funzione principale del tubo capillare Rukin è quella di garantire che la resistenza elettrica tra l'elettrodo di riferimento e quello di lavoro sia mantenuta al minimo assoluto. Questo risultato è ottenuto grazie al design della provetta, che consente un'efficiente conduttività elettrica senza perdite o interferenze significative.
-
Controllo preciso del potenziale: Grazie alla resistenza minima, il tubo capillare Rukin consente un controllo più accurato della differenza di potenziale tra gli elettrodi. Questa precisione è fondamentale per diverse applicazioni elettrolitiche, dalla produzione industriale di metalli alla ricerca scientifica, dove anche piccole deviazioni di potenziale possono portare a errori significativi.
-
Maggiore stabilità: Il design del tubo capillare Rukin contribuisce anche alla stabilità complessiva della cella elettrolitica. Riducendo la probabilità di fluttuazioni di potenziale, aiuta a mantenere un ambiente coerente e stabile per il processo elettrolitico.
Considerazioni su materiali e design
-
Selezione del materiale: Il tubo capillare Rukin è generalmente realizzato con materiali che offrono un'elevata conduttività elettrica e resistenza chimica, come il platino o l'oro. Questi materiali assicurano che il tubo possa resistere alle condizioni difficili dei processi elettrolitici senza degradarsi.
-
Geometria del tubo: La geometria del tubo capillare Rukin è stata accuratamente progettata per ottimizzare il flusso di corrente elettrica. Ciò include considerazioni sulla lunghezza del tubo, sul diametro e sul posizionamento dei canali di ingresso e di uscita, che contribuiscono a ridurre al minimo la resistenza e a migliorare la conduttività.
In sintesi, il tubo capillare Rukin è un componente indispensabile nella progettazione delle celle elettrolitiche, in quanto offre una soluzione robusta per garantire una resistenza minima e un controllo preciso del potenziale. L'attenta selezione dei materiali e il design ottimizzato ne fanno un elemento chiave per ottenere risultati elettrolitici affidabili e precisi.
Tipi di celle elettrolitiche
Cella elettrolitica a camera singola
Le celle elettrolitiche a camera singola sono progettate specificamente per gli studi sulla corrosione, dove gli elettrodi di ricerca e quelli ausiliari sono alloggiati nella stessa camera. Questa configurazione semplifica l'installazione eliminando la necessità di una complessa compartimentazione e rappresenta la scelta ideale per i ricercatori che si concentrano sui meccanismi di corrosione.

In queste celle, la vicinanza degli elettrodi di ricerca e ausiliari consente di monitorare in tempo reale i processi di corrosione. Ciò è particolarmente vantaggioso negli studi in cui si osservano rapide variazioni del potenziale elettrodico, in quanto riduce al minimo l'intervallo di tempo tra le misurazioni. Inoltre, il design a camera singola riduce il rischio di contaminazione che potrebbe derivare da camere separate, garantendo una raccolta dati più accurata e coerente.
Inoltre, l'uso di una singola camera facilita il controllo dell'ambiente elettrolitico. I ricercatori possono regolare con precisione la composizione e la concentrazione dell'elettrolita, nonché la temperatura e la pressione all'interno della camera, per simulare diverse condizioni di corrosione. Questa adattabilità è fondamentale per capire come i diversi fattori influenzino i tassi e i modelli di corrosione.
Nonostante i suoi vantaggi, la configurazione a camera singola presenta dei limiti. Ad esempio, la mancanza di un diaframma significa che non esiste una barriera fisica per separare i prodotti dell'elettrodo di ricerca da quelli dell'elettrodo ausiliario. Questo può portare a potenziali interferenze nelle misurazioni, in particolare negli studi che coinvolgono sostanze altamente reattive o volatili. Pertanto, sebbene il design a camera singola sia pratico per molti studi sulla corrosione, potrebbe non essere adatto a tutte le condizioni sperimentali.
Cella elettrolitica a doppia camera
La cella elettrolitica a doppia camera è progettata per attenuare l'interferenza dei prodotti degli elettrodi ausiliari utilizzando un diaframma che separa l'elettrodo di lavoro dall'elettrodo ausiliario. Questa configurazione è particolarmente vantaggiosa per ridurre la contaminazione incrociata e garantire misure più precise.

Caratteristiche e vantaggi principali
- Materiale del diaframma: Tipicamente costruito con vetro poroso, il diaframma consente il passaggio degli ioni impedendo il contatto diretto con i prodotti dell'elettrodo e mantenendo così l'integrità dell'ambiente di lavoro.
- Distribuzione uniforme della corrente: Il diaframma assicura una distribuzione uniforme della corrente nella cella elettrolitica, fondamentale per ottenere risultati coerenti e affidabili.
- Riduzione delle interferenze: Isolando l'elettrodo di lavoro dall'elettrodo ausiliario, il design a doppia camera riduce significativamente il potenziale di interferenza, migliorando l'accuratezza dei dati raccolti.
Applicazioni e vantaggi
- Studi sulla corrosione: La configurazione a doppia camera è particolarmente vantaggiosa negli studi di corrosione in cui è essenziale mantenere la purezza dell'elettrodo di lavoro.
- Misure di precisione: Per le applicazioni che richiedono un'elevata precisione, come nel caso della chimica analitica, la cella a doppia camera offre un ambiente controllato che riduce al minimo le influenze esterne.
Questo design non solo migliora l'accuratezza delle misure, ma prolunga anche la vita operativa degli elettrodi riducendo l'esposizione a sottoprodotti potenzialmente dannosi.
Tipi di elettrolisi basati sulla generazione di prodotti
Tipo di elettrolisi dell'acqua
L'elettrolisi dell'acqua è un processo fondamentale che si verifica in condizioni specifiche, che coinvolgono principalmente acidi ossigenati , basi forti e soluzioni di sali acidi ossigenati di metalli attivi . Questo tipo di elettrolisi è caratterizzato dalla decomposizione delle molecole d'acqua in gas di idrogeno e ossigeno, una reazione scientificamente interessante e industrialmente significativa.
Per comprendere l'elettrolisi dell'acqua, è essenziale approfondire la natura degli elettroliti coinvolti. Acidi ossigenati come l'acido nitrico (HNO₃) e l'acido solforico (H₂SO₄), contengono atomi di ossigeno legati all'atomo centrale, che facilitano il rilascio di ossigeno durante il processo di elettrolisi. Analogamente, basi forti come l'idrossido di sodio (NaOH) e l'idrossido di potassio (KOH) forniscono un ambiente altamente alcalino che favorisce la dissociazione delle molecole d'acqua.

Nel contesto delle soluzioni saline acide ossigenate di metalli attivi come il nitrato di sodio (NaNO₃) o il solfato di potassio (K₂SO₄), la presenza di metalli attivi come il sodio (Na) o il potassio (K) aumenta la conducibilità della soluzione, facilitando così il processo di elettrolisi. Questi sali, una volta disciolti in acqua, creano un mezzo conduttivo in cui i metalli attivi agiscono come portatori di carica, favorendo il flusso di elettroni necessario per l'elettrolisi.
L'elettrolisi dell'acqua non è solo un processo chiave in varie applicazioni industriali, come la produzione di idrogeno gassoso per le celle a combustibile, ma è anche un concetto fondamentale dell'elettrochimica. La comprensione delle condizioni specifiche in cui avviene questo processo - in presenza di acidi ossigenati, basi forti o soluzioni di sali acidi ossigenati di metalli attivi - è fondamentale per ottimizzare la progettazione delle celle elettrolitiche e garantire una conversione energetica efficiente.
Decomposizione del tipo di elettrolita
La decomposizione del tipo di elettrolita è un processo specifico che si verifica in determinate condizioni, in particolare con acidi privi di ossigeno e soluzioni contenenti metalli inattivi e sali privi di ossigeno. Questo tipo di elettrolisi si distingue dagli altri per l'assenza di ossigeno, che influenza in modo significativo le reazioni chimiche agli elettrodi.
In ambienti privi di ossigeno, gli acidi e i sali non contribuiscono alla formazione di ossigeno gassoso, che è un sottoprodotto comune in molti processi di elettrolisi. L'attenzione si concentra invece sull'interazione diretta tra l'elettrolita e gli elettrodi, che porta alla decomposizione dell'elettrolita stesso. Questo processo è fondamentale nelle applicazioni industriali, dove il mantenimento di un ambiente privo di ossigeno è essenziale per prevenire la contaminazione e garantire la purezza dei prodotti finali.
Ad esempio, nella produzione di alcuni metalli, l'utilizzo di acidi e sali privi di ossigeno può prevenire la formazione di ossidi, che potrebbero altrimenti compromettere la qualità del metallo. L'assenza di ossigeno semplifica anche le fasi di post-lavorazione, poiché non è necessario rimuovere dal prodotto le impurità basate sull'ossigeno.
In sintesi, la decomposizione di tipo elettrolitico si caratterizza per la sua dipendenza da condizioni di assenza di ossigeno, che non solo alterano i percorsi chimici, ma migliorano anche l'efficienza e la purezza dei prodotti risultanti.
Tipo alcalino a rilascio di idrogeno
L'elettrolisi alcalina a rilascio di idrogeno è un processo specifico che avviene in presenza di metalli attivi e soluzioni acide anaerobiche. Questo tipo di elettrolisi è caratterizzato dal rilascio di idrogeno gassoso al catodo, che è il risultato diretto della riduzione degli ioni di idrogeno presenti nella soluzione acida anaerobica. I metalli attivi, tipicamente alcalini o alcalino-terrosi, svolgono un ruolo cruciale in questo processo, fornendo gli elettroni necessari per la reazione di riduzione.
La natura anaerobica della soluzione acida è essenziale per evitare la formazione di ossigeno gassoso, che altrimenti complicherebbe il processo di elettrolisi. In un ambiente anaerobico, gli ioni idrogeno sono le specie primarie che subiscono la riduzione, portando alla produzione efficiente di idrogeno gassoso. Questo processo è particolarmente significativo nelle applicazioni industriali in cui la produzione di idrogeno gassoso è un obiettivo chiave, come nella produzione di alcuni prodotti chimici o nella tecnologia delle celle a combustibile.
Per facilitare questo tipo di elettrolisi, la cella elettrolitica deve essere progettata con considerazioni specifiche. L'uso di un diaframma, come il vetro poroso, è spesso impiegato per separare l'elettrodo di lavoro dall'elettrodo ausiliario, assicurando una distribuzione uniforme della corrente e riducendo al minimo l'interferenza dei prodotti dell'elettrodo ausiliario. Inoltre, la concentrazione dell'elettrolita deve essere attentamente controllata per evitare la migrazione di sostanze attive, che potrebbe influenzare negativamente il processo di elettrolisi.
In sintesi, l'elettrolisi alcalina a rilascio di idrogeno è un processo specializzato che sfrutta la reattività dei metalli attivi e le proprietà delle soluzioni acide anaerobiche per produrre idrogeno gassoso in modo efficiente. Un'adeguata progettazione della cella elettrolitica e la scelta dei materiali sono fondamentali per garantire il successo di questo processo nelle applicazioni industriali.
Tipo di acido generatore di ossigeno
Il Tipo acido generatore di ossigeno è caratterizzato dalla presenza di soluzioni di ossigenati metallici inattivi. Queste soluzioni, che comprendono composti come nitrati e solfati, sono particolarmente importanti nelle applicazioni industriali in cui la generazione di ossigeno è un processo critico.
In questo tipo di elettrolisi, i metalli inattivi, che non partecipano prontamente alle reazioni chimiche, svolgono un ruolo cruciale. Gli ossigenati presenti nella soluzione agiscono come fonte primaria di ossigeno, facilitando il processo elettrolitico. La stabilità di questi metalli inattivi assicura che la cella elettrolitica possa funzionare in modo efficiente senza il rischio di contaminazione o di reazioni indesiderate.
Il processo prevede la decomposizione degli ossigenati, con conseguente rilascio di ossigeno gassoso all'anodo. Questo rilascio è il risultato diretto dell'azione elettrolitica, in cui la corrente elettrica applicata provoca la scomposizione degli ossigenati nei loro elementi costitutivi. I metalli inattivi rimangono in gran parte inalterati, mantenendo l'integrità e la purezza dell'ambiente elettrolitico.
I fattori chiave da considerare in questo tipo di elettrolisi sono la concentrazione degli ossigenati nella soluzione e la stabilità dei metalli inattivi. La concentrazione deve essere attentamente controllata per garantire una generazione ottimale di ossigeno, mentre i metalli devono essere scelti in base alla loro inerzia per evitare qualsiasi interferenza con il processo elettrolitico.
In generale, il tipo acido generatore di ossigeno dell'elettrolisi è essenziale nelle industrie in cui è necessario un controllo preciso della produzione di ossigeno, come nella raffinazione dei metalli e in alcuni processi di produzione chimica.
Conversione di energia e condizioni di elettrolisi
Caratteristiche del catodo e dell'anodo
Nei processi elettrolitici, il ruolo del catodo e dell'anodo può variare in modo significativo a seconda della reazione specifica che si verifica all'interno della cella. Sebbene questi elettrodi siano componenti fondamentali della cella elettrolitica, il loro coinvolgimento nella reazione chimica non è sempre semplice.
Il catodo, tipicamente sede della riduzione, e l'anodo, dove avviene l'ossidazione, non partecipano necessariamente in modo diretto alla reazione. Ciò significa che gli elettrodi stessi possono rimanere chimicamente inerti durante il processo, fungendo semplicemente da condotti per il flusso di elettroni. Ad esempio, in alcune celle elettrolitiche, gli elettrodi sono costituiti da materiali come il platino o la grafite, noti per la loro stabilità chimica e la resistenza alla reazione nelle condizioni dell'elettrolisi.
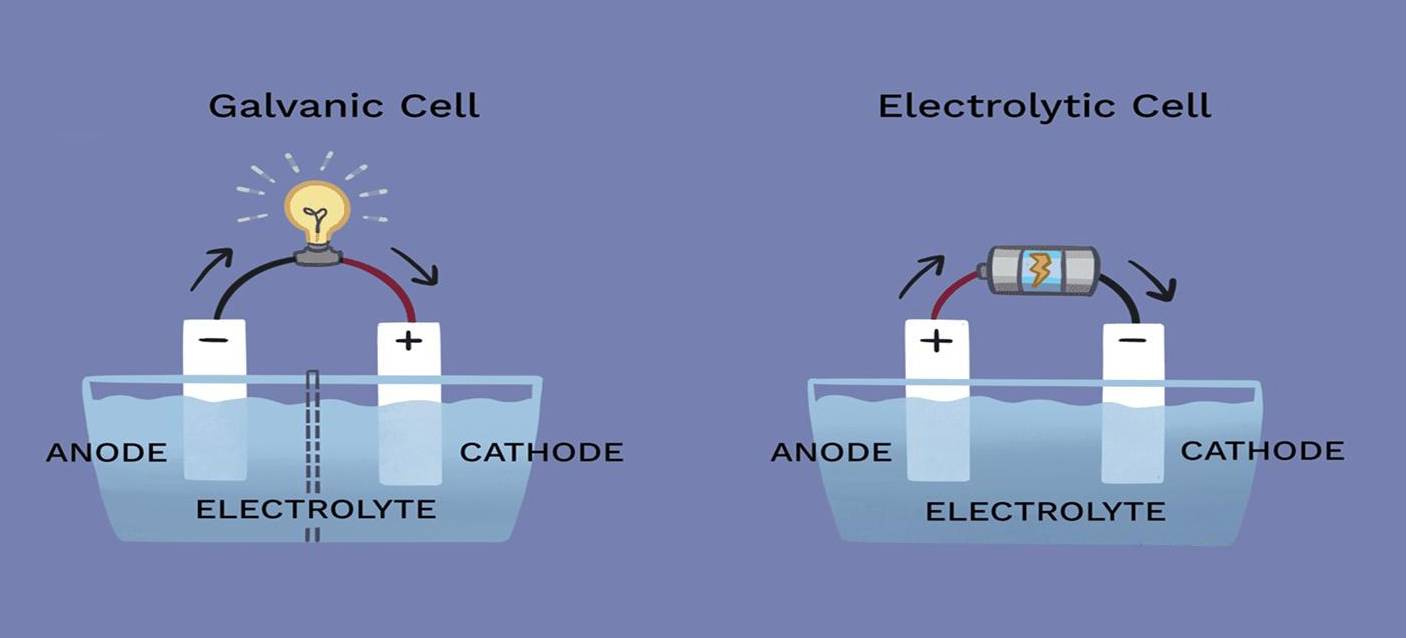
Inoltre, il requisito dell'inerzia non è universale. In alcune applicazioni, vengono impiegati elettrodi attivi che possono subire cambiamenti durante il processo. Questi elettrodi attivi possono influenzare le dinamiche di reazione, alterando potenzialmente l'efficienza o il risultato dell'elettrolisi. Pertanto, la scelta tra elettrodi inerti e attivi è una considerazione critica per la progettazione che influisce sulle prestazioni complessive e sull'efficacia della cella elettrolitica.
Condizioni per l'elettrolisi
L'elettrolisi è un processo che richiede condizioni specifiche per funzionare efficacemente. In sostanza, l'elettrolisi richiede alimentazione a corrente continua (DC) . Questo assicura un flusso costante di energia elettrica, essenziale per l'attivazione delle reazioni chimiche agli elettrodi.
La configurazione prevede connessioni distinte per il catodo e anodo . Il catodo, che attrae i cationi, è tipicamente collegato al terminale negativo dell'alimentazione CC, mentre l'anodo, che attrae gli anioni, è collegato al terminale positivo. Queste connessioni sono fondamentali per la corretta direzione del flusso di elettroni e per le successive trasformazioni chimiche.
Affinché si verifichi l'elettrolisi, gli elettrodi devono essere immersi in una soluzione soluzione elettrolitica o un elettrolita fuso . L'elettrolita serve come mezzo attraverso il quale gli ioni possono muoversi, facilitando la conduzione dell'elettricità. La scelta dell'elettrolita è fondamentale, poiché deve essere in grado di dissociarsi in ioni che possono partecipare alle reazioni elettrochimiche.
Infine, un circuito chiuso è necessario per completare il percorso elettrico. Questo assicura che gli elettroni possano fluire dall'anodo al catodo attraverso il circuito esterno, mentre gli ioni si muovono attraverso la soluzione elettrolitica. Senza un circuito chiuso, il flusso di elettricità si interrompe e il processo di elettrolisi cessa.
Prodotti correlati
- Cella Elettrochimica per Corrosione Piatta
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Bagno d'acqua a doppio strato a cinque porte Cella elettrolitica elettrochimica
- Bagno d'acqua per cella elettrochimica elettrolitica multifunzionale a strato singolo e doppio
Articoli correlati
- Comprendere la corrosione piatta delle celle elettrolitiche: Applicazioni, meccanismi e tecniche di prevenzione
- Tecniche avanzate di valutazione dei rivestimenti tramite celle elettrolitiche
- Come realizzare il proprio elettrodo di riferimento Ag/AgCl per gli esperimenti elettrochimici
- Applicazioni della cella elettrolitica di tipo H nell'estrazione dei metalli
- Tecniche avanzate di celle elettrolitiche per una ricerca di laboratorio all'avanguardia














