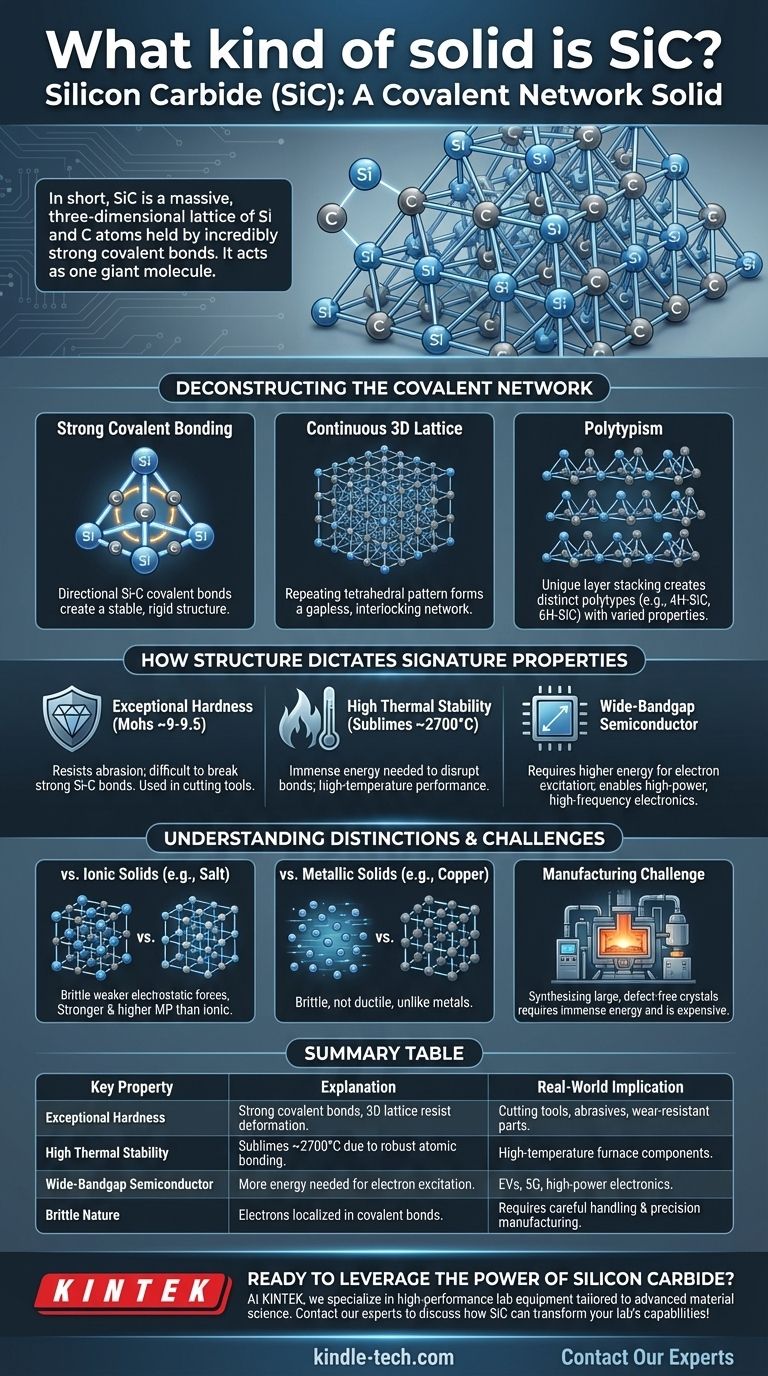
In breve, il Carburo di Silicio (SiC) è un solido a rete covalente. Questa classificazione significa che i suoi atomi di silicio e carbonio sono bloccati in un massiccio reticolo tridimensionale tenuto insieme da legami covalenti estremamente forti e direzionali. A differenza dei solidi molecolari con forze deboli tra le molecole, l'intero cristallo di SiC agisce efficacemente come una singola, gigantesca molecola.
La classificazione del SiC come solido a rete covalente non è solo un'etichetta; è la spiegazione fondamentale delle sue proprietà eccezionali. Comprendere il suo reticolo atomico rigido è la chiave per cogliere la sua estrema durezza, la stabilità ad alta temperatura e il comportamento elettronico unico.

Decostruire la Struttura a Rete Covalente
Per comprendere il SiC, devi prima visualizzare la sua architettura atomica sottostante. È questa struttura che detta quasi tutte le sue caratteristiche utili.
La Natura del Legame Covalente nel SiC
Il Carburo di Silicio è formato da atomi di silicio (Si) e carbonio (C). Questi due elementi hanno una differenza relativamente piccola di elettronegatività, il che li porta a condividere elettroni e a formare legami covalenti molto forti e stabili.
Questi legami sono altamente direzionali. Ogni atomo di carbonio è legato a quattro atomi di silicio, e ogni atomo di silicio è legato a quattro atomi di carbonio in una rigida disposizione tetraedrica.
Un Reticolo 3D Continuo
Questo modello di legame tetraedrico si ripete all'infinito in tutte e tre le dimensioni. Questo crea una rete continua e interconnessa senza punti deboli o molecole individuali.
Pensalo come una struttura simile al diamante, ma con atomi di silicio e carbonio alternati invece che solo carbonio. Questa struttura rigida e senza interruzioni è la fonte dell'immensa forza fisica del SiC.
Il Concetto di Politipismo
Una caratteristica unica del SiC è il politipismo. Mentre il legame tetraedrico Si-C locale è costante, gli strati di questi tetraedri possono essere impilati in diverse sequenze.
Queste diverse disposizioni di impilamento creano distinte strutture cristalline chiamate politipi, come il 4H-SiC e il 6H-SiC. Sebbene siano tutti SiC, questi politipi hanno proprietà elettroniche leggermente diverse, rendendoli adatti a diverse applicazioni semiconduttrici.
Come la Struttura Detta le Proprietà Distintive del SiC
Il modello a rete covalente spiega direttamente perché il SiC si comporta in un certo modo. Le proprietà macroscopiche del materiale sono una diretta conseguenza del suo legame e della sua struttura microscopici.
Eccezionale Durezza e Resistenza
Per graffiare o deformare il SiC, è necessario rompere fisicamente i potenti legami covalenti Si-C. Poiché l'intero cristallo è una singola rete di questi legami, esso mostra un'incredibile resistenza all'abrasione e alla deformazione.
Sulla scala di Mohs della durezza, il SiC (~9-9.5) è secondo solo al diamante (10), rendendolo un materiale d'élite per utensili da taglio, abrasivi e componenti resistenti all'usura.
Elevata Stabilità Termica
La fusione o la decomposizione di un solido richiede di fornire ai suoi atomi energia sufficiente per superare le forze che li tengono uniti. L'immensa forza dei legami covalenti Si-C significa che è necessaria una vasta quantità di energia termica per rompere il reticolo.
Di conseguenza, il SiC non fonde a pressione atmosferica, ma invece sublima (si trasforma direttamente in gas) a temperature estremamente elevate, intorno ai 2700 °C (4900 °F).
Comportamento Semiconduttore Unico
Mentre i legami forti sono caratteristici di un isolante elettrico come il diamante, l'energia richiesta per eccitare un elettrone in uno stato conduttivo (il bandgap) nel SiC è inferiore a quella del diamante.
Questo colloca il SiC in una categoria speciale di semiconduttori a bandgap ampio. Il suo bandgap è significativamente più ampio di quello del silicio puro, consentendo all'elettronica basata su SiC di operare a tensioni, temperature e frequenze molto più elevate.
Comprendere i Compromessi e le Distinzioni
Collocare il SiC nel contesto di altri solidi chiarisce la sua posizione unica. Le sue proprietà sono un compromesso definito dal suo legame.
SiC vs. Solidi Ionici (es. Sale)
I solidi ionici come il cloruro di sodio (NaCl) sono tenuti insieme da attrazione elettrostatica non direzionale tra ioni positivi e negativi. Sebbene formino cristalli, questi legami sono generalmente più deboli dei legami covalenti del SiC, rendendoli più morbidi e conferendo loro punti di fusione molto più bassi.
SiC vs. Solidi Metallici (es. Rame)
I metalli sono caratterizzati da un "mare" di elettroni delocalizzati che circondano un reticolo di ioni positivi. Questo mare di elettroni consente ai metalli di essere conduttivi e duttili (malleabili). Al contrario, gli elettroni del SiC sono bloccati in legami covalenti localizzati, rendendolo un semiconduttore e intrinsecamente fragile.
La Sfida della Produzione
La stessa forza che rende il SiC così desiderabile lo rende anche incredibilmente difficile da produrre. La sintesi di grandi cristalli singoli di SiC privi di difetti richiede un'immensa energia e processi sofisticati (come il metodo Lely), rendendolo significativamente più costoso del silicio.
Fare la Scelta Giusta per la Tua Applicazione
Comprendere la classificazione del SiC come solido a rete covalente ti consente di prevedere il suo comportamento e i migliori casi d'uso.
- Se il tuo obiettivo principale è la prestazione meccanica: Riconosci che la sua rete covalente è la fonte diretta della sua durezza e resistenza all'usura di prim'ordine, rendendolo ideale per abrasivi, sabbiatura e guarnizioni meccaniche durevoli.
- Se il tuo obiettivo principale è l'elettronica di potenza: Comprendi che la sua rete covalente crea un semiconduttore a bandgap ampio, essenziale per la costruzione di robusti inverter di potenza, caricabatterie per veicoli elettrici e moduli di comunicazione 5G che superano il silicio.
- Se il tuo obiettivo principale è la scienza dei materiali: Classifica il SiC come un prototipo di solido a rete covalente, usandolo come punto di riferimento per la durezza e la stabilità termica quando lo si confronta con altre ceramiche avanzate come il nitruro di boro o il nitruro di silicio.
In definitiva, sapere che il Carburo di Silicio è un solido a rete covalente è il primo principio per comprendere e applicare le sue straordinarie capacità.
Tabella riassuntiva:
| Proprietà Chiave | Spiegazione | Implicazione nel Mondo Reale |
|---|---|---|
| Durezza Eccezionale | Forti legami covalenti in un reticolo 3D resistono alla deformazione. | Ideale per utensili da taglio, abrasivi e parti resistenti all'usura. |
| Elevata Stabilità Termica | Sublima a ~2700°C grazie a robusti legami atomici. | Adatto per applicazioni ad alta temperatura come i componenti dei forni. |
| Semiconduttore a Bandgap Ampio | Gli elettroni richiedono più energia per eccitarsi, consentendo un funzionamento ad alta potenza. | Utilizzato in veicoli elettrici, tecnologia 5G ed elettronica di potenza per prestazioni superiori. |
| Natura Fragile | Gli elettroni sono localizzati in legami covalenti, limitando la duttilità. | Richiede un'attenta manipolazione e processi di produzione di precisione. |
Pronto a sfruttare la potenza del Carburo di Silicio nel tuo laboratorio? Presso KINTEK, siamo specializzati nella fornitura di attrezzature e materiali di consumo da laboratorio ad alte prestazioni, su misura per le esigenze della scienza dei materiali avanzata. Che tu stia sviluppando semiconduttori di nuova generazione o richieda componenti durevoli per processi ad alta temperatura, la nostra esperienza ti garantisce le soluzioni giuste per risultati superiori. Contatta i nostri esperti oggi stesso per discutere come il SiC può trasformare le capacità del tuo laboratorio!
Guida Visiva
Prodotti correlati
- Lastra Ceramica in Carburo di Silicio (SiC) Resistente all'Usura, Ceramica Avanzata Fine Ingegneristica
- Elementi Riscaldanti Termici in Carburo di Silicio SiC per Forno Elettrico
- Porta wafer personalizzati in PTFE per laboratorio e lavorazione di semiconduttori
- Lente in silicio monocristallino ad alta resistenza infrarossa
- Parti ceramiche avanzate di nitruro di boro (BN) per ingegneria fine
Domande frequenti
- Quali sono le caratteristiche del SiC? Sblocca prestazioni ad alta temperatura, durezza ed inerzia chimica
- Qual è più duro, il carburo di silicio o il carburo di tungsteno? Scopri la chiave per la selezione dei materiali
- Il carburo di silicio è migliore della ceramica? Scopri la ceramica tecnica superiore per la tua applicazione
- Qual è l'espansione termica del SiC? Domina il suo basso CTE per prestazioni superiori ad alta temperatura
- Il carburo di silicio è resistente al calore? Sblocca prestazioni superiori a temperature estreme



















