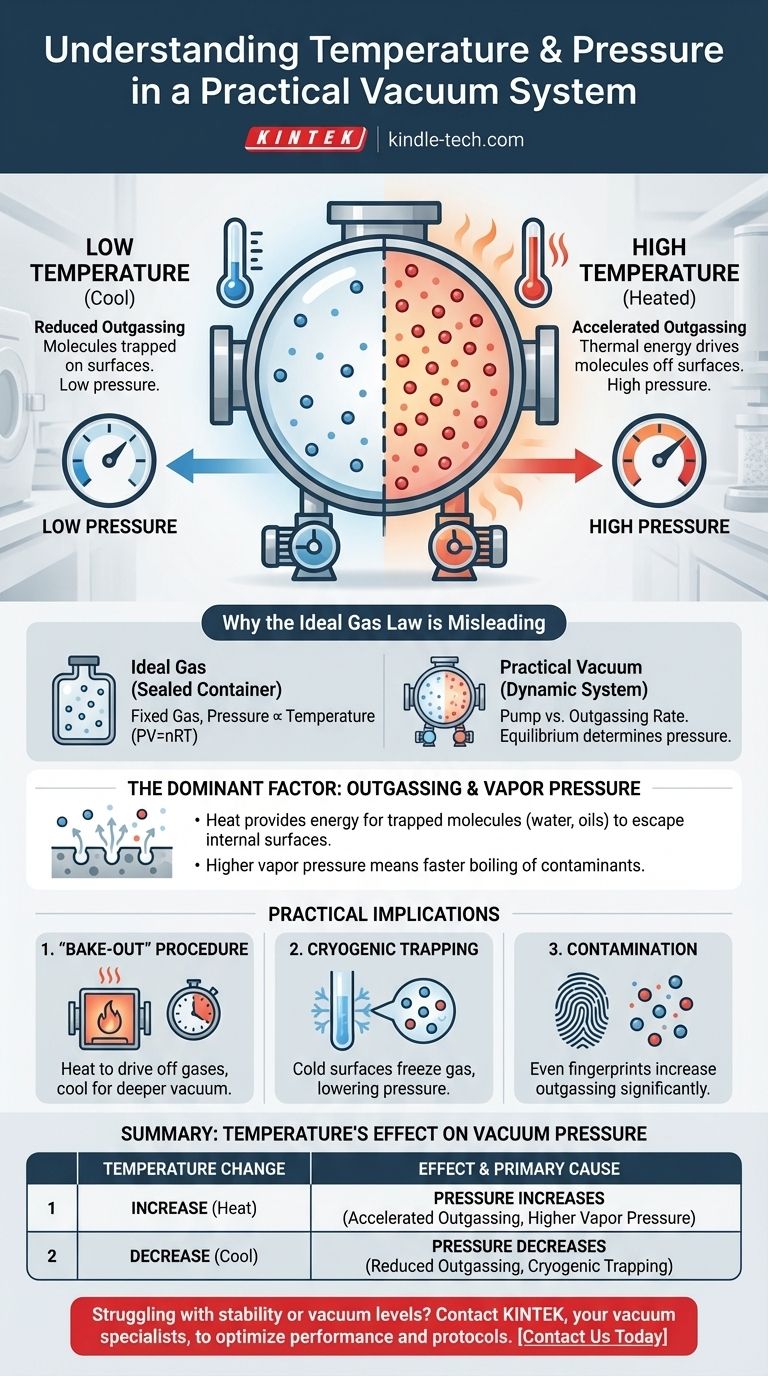
In un sistema a vuoto pratico, la relazione è diretta: l'aumento della temperatura del sistema aumenterà la pressione, degradando così la qualità del vuoto. Ciò si verifica perché il calore fornisce l'energia alle molecole intrappolate sulle superfici interne della camera per sfuggire nello spazio del vuoto. Questo processo, noto come degassamento, è la fonte dominante di pressione negli ambienti ad alto vuoto.
La pressione all'interno di una camera a vuoto reale non è regolata dalla Legge dei Gas Ideali, ma dal tasso di degassamento dalle sue superfici interne. Temperature più elevate aumentano questo tasso, rilasciando più molecole di gas e quindi aumentando la pressione complessiva.

Perché la Legge dei Gas Ideali è fuorviante qui
L'idea sbagliata di un "gas contenuto"
La familiare Legge dei Gas Ideali (PV=nRT) descrive la relazione tra pressione, volume e temperatura per una quantità fissa di gas in un contenitore sigillato. In questo scenario, la pressione è direttamente proporzionale alla temperatura.
Una camera a vuoto, tuttavia, non è un contenitore sigillato con una quantità fissa di gas. È un sistema dinamico in cui una pompa rimuove attivamente le molecole.
La realtà: un equilibrio dinamico
La pressione nel vuoto è determinata dall'equilibrio tra la velocità con cui la pompa rimuove le molecole e la velocità con cui nuove molecole entrano nel sistema. La fonte primaria di queste nuove molecole sono le superfici interne della camera stessa.
Il fattore dominante: degassamento e pressione di vapore
Cos'è il degassamento?
Tutti i materiali hanno molecole di gas adsorbite (attaccate alla superficie) o assorbite (intrappolate all'interno del materiale). Nel vuoto, queste molecole sfuggiranno gradualmente dalle superfici.
Questo processo è chiamato degassamento. Il principale colpevole nella maggior parte dei sistemi a vuoto è il vapore acqueo, ma anche oli, solventi e gas intrappolati durante la produzione contribuiscono.
Come la temperatura guida il degassamento
Il riscaldamento delle pareti della camera a vuoto trasferisce energia termica alle molecole intrappolate. Questa maggiore energia consente loro di superare le forze che le trattengono sulla superficie, facendole rilasciare nel vuoto.
Una temperatura più elevata significa un tasso di degassamento significativamente più alto, il che porta direttamente a una pressione più elevata.
Il ruolo della pressione di vapore
Per qualsiasi sostanza condensata, come una gocciolina d'acqua o una pellicola d'olio all'interno della camera, esiste una pressione di vapore. Questa è la pressione alla quale la sostanza è in equilibrio con il proprio gas a una data temperatura.
All'aumentare della temperatura, la pressione di vapore di questi contaminanti aumenta esponenzialmente. Se la pressione di vapore del contaminante supera la pressione nella camera, esso evaporerà rapidamente, causando un aumento drammatico della pressione.
Comprendere le implicazioni pratiche
La procedura di "bake-out"
Gli ingegneri sfruttano questa relazione temperatura-pressione per ottenere un vuoto ultra-alto (UHV). Un sistema viene riscaldato, spesso a centinaia di gradi Celsius, per molte ore o giorni mentre le pompe sono in funzione.
Questo "bake-out" accelera drasticamente il degassamento, eliminando l'acqua intrappolata e altri contaminanti in modo che le pompe possano rimuoverli permanentemente. Dopo che il sistema si è raffreddato, il tasso di degassamento è notevolmente inferiore, consentendo un vuoto molto più profondo.
L'impatto della criogenia
Viene utilizzato anche l'effetto opposto. Superfici estremamente fredde, note come criotrappole o criopompe, agiscono come assorbitori di molecole di gas.
Quando una molecola come l'acqua colpisce una superficie molto fredda, si congela istantaneamente e la sua pressione di vapore diventa trascurabile. Questo la rimuove efficacemente dal vuoto, abbassando drasticamente la pressione del sistema.
Il problema della contaminazione
Questo principio evidenzia perché la pulizia è fondamentale nella tecnologia del vuoto. Una singola impronta digitale contiene oli e acqua che agiranno come una significativa fonte di degassamento, limitando la pressione massima che un sistema può raggiungere, specialmente quando riscaldato.
Fare la scelta giusta per il tuo obiettivo
Per gestire efficacemente un sistema a vuoto, è necessario trattare la temperatura come una variabile di controllo primaria.
- Se il tuo obiettivo principale è ottenere il vuoto più profondo possibile: devi riscaldare la camera in un "bake-out" mentre pompi per espellere i gas intrappolati, quindi lasciarla raffreddare per raggiungere la pressione target.
- Se il tuo obiettivo principale è mantenere un vuoto stabile durante un processo: devi garantire un controllo preciso della temperatura, poiché anche piccole fluttuazioni termiche causeranno cambiamenti di pressione a causa delle variazioni dei tassi di degassamento.
- Se il tuo obiettivo principale è trattare sostanze ad alta pressione di vapore: potresti aver bisogno di utilizzare il raffreddamento criogenico (trappole fredde) per catturare i vapori e impedire che sovraccarichino le tue pompe.
In definitiva, padroneggiare la pressione nel tuo sistema a vuoto significa padroneggiare l'energia termica delle sue superfici.
Tabella riassuntiva:
| Variazione di temperatura | Effetto sulla pressione del vuoto | Causa principale |
|---|---|---|
| Aumento | La pressione aumenta | Degassamento accelerato e maggiore pressione di vapore dei contaminanti. |
| Diminuzione | La pressione diminuisce | Tasso di degassamento ridotto; le superfici criogeniche possono intrappolare le molecole. |
Hai problemi con l'instabilità della pressione o non riesci a raggiungere il livello di vuoto desiderato? La gestione termica del tuo sistema è probabilmente la chiave. KINTEK è specializzata in apparecchiature e materiali di consumo da laboratorio per applicazioni di vuoto precise. I nostri esperti possono aiutarti a selezionare i componenti giusti e a sviluppare protocolli per il bake-out, il controllo della temperatura o la trappola criogenica per garantire che i tuoi processi a vuoto siano affidabili e ripetibili. Contatta oggi i nostri specialisti del vuoto per ottimizzare le prestazioni del tuo sistema.
Guida Visiva
Prodotti correlati
- Pressa Idraulica Riscaldata con Piastre Riscaldate per Pressa a Caldo da Laboratorio per Scatola Sottovuoto
- Pressa termica idraulica elettrica riscaldata a vuoto per laboratorio
- Fornace per Trattamento Termico Sottovuoto con Rivestimento in Fibra Ceramica
- Pressa Idraulica Manuale Riscaldata ad Alta Temperatura con Piastre Riscaldate per Laboratorio
- Fornace a vuoto di molibdeno per trattamento termico
Domande frequenti
- Quale ruolo svolge una pressa idraulica a caldo da laboratorio nella produzione di pannelli compositi a base di lolla di riso? Raggiungere la densità strutturale
- Quali sono i vantaggi dell'utilizzo di apparecchiature per sinterizzazione a pressatura a caldo? Massimizzare le prestazioni del CoSb3 e i valori ZT
- Qual è lo scopo di un sistema di pressatura a caldo dopo la riduzione della polvere di ferro in un letto fluidizzato? Stabilizzare il DRI
- Perché è necessario un controllo preciso della pressione tramite un sistema idraulico durante la pressatura a caldo? Ottimizzare le prestazioni del nanorame
- Come una pressa a caldo da laboratorio migliora le prestazioni delle leghe? Ottimizzare la sinterizzazione a fase liquida per materiali ad alta resistenza



















