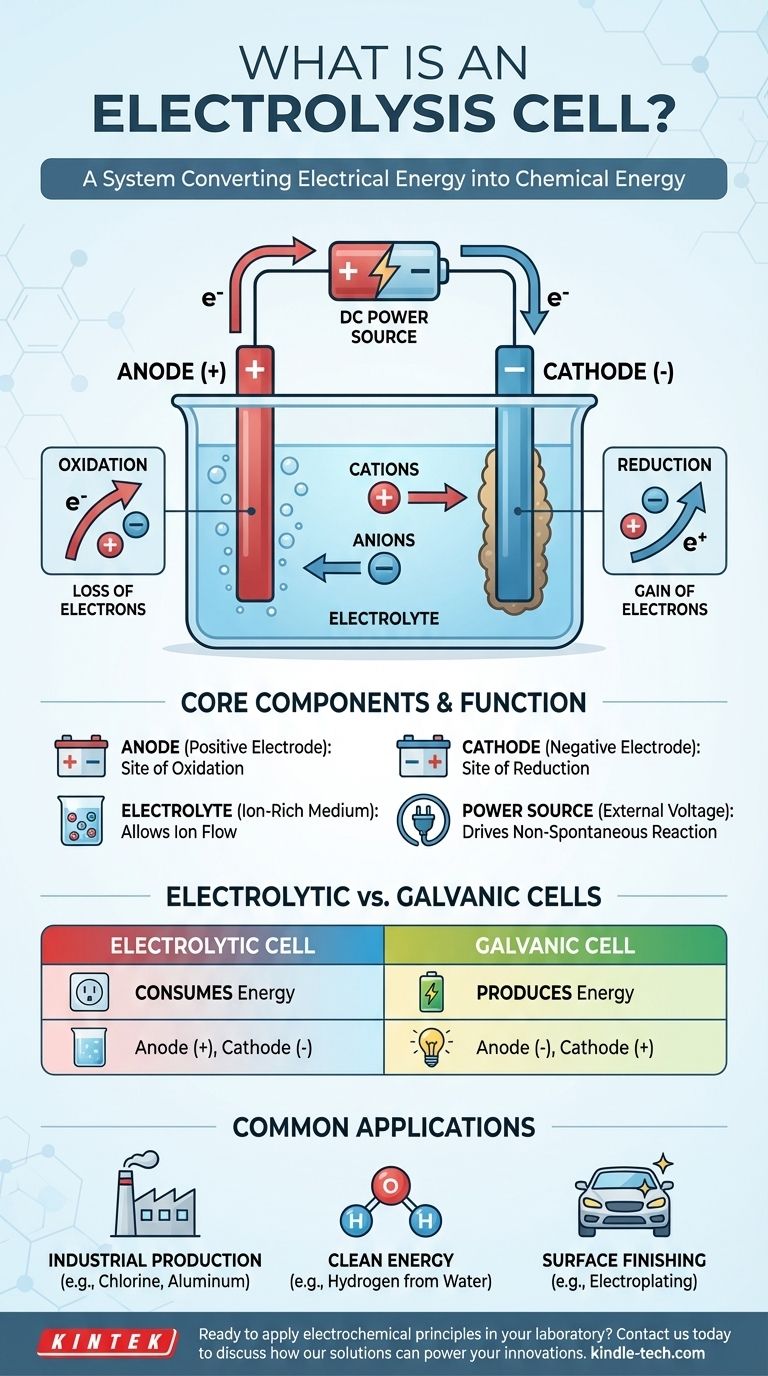
Fondamentalmente, una cella elettrolitica è un dispositivo che utilizza l'energia elettrica per guidare una reazione chimica che altrimenti non avverrebbe spontaneamente. In effetti, inverte il processo di una batteria, consumando energia per decomporre composti o sintetizzarne di nuovi. Ciò si ottiene facendo passare una corrente elettrica continua attraverso una sostanza chiamata elettrolita, forzando cambiamenti chimici su due elettrodi.
Una cella elettrolitica è meglio intesa come un sistema per convertire l'energia elettrica in energia chimica. Funziona applicando una tensione esterna per superare lo stato naturale di un sistema chimico, forzando gli ioni a reagire e a creare nuove sostanze.

Come funziona una cella elettrolitica
Per comprendere il concetto, è essenziale comprendere i tre componenti principali e come interagiscono quando viene introdotta l'elettricità. Il processo è un flusso di carica controllato e diretto che si traduce in una trasformazione chimica.
I tre componenti essenziali
Una cella elettrolitica è composta da tre parti principali:
- Un Anodo: l'elettrodo collegato al terminale positivo della fonte di alimentazione.
- Un Catodo: l'elettrodo collegato al terminale negativo della fonte di alimentazione.
- Un Elettrolita: una sostanza contenente ioni in movimento libero, come un sale fuso o un composto ionico disciolto in un solvente come l'acqua.
Il ruolo della tensione esterna
A differenza di una batteria (una cella galvanica) che produce spontaneamente tensione, una cella elettrolitica richiede una fonte di alimentazione esterna. Questa tensione applicata stabilisce un forte campo elettrico e detta la polarità degli elettrodi, rendendo l'anodo positivo e il catodo negativo.
Il flusso di ioni ed elettroni
La tensione applicata forza gli ioni all'interno dell'elettrolita a migrare. Gli ioni caricati positivamente (cationi) sono attratti verso il catodo negativo, mentre gli ioni caricati negativamente (anioni) sono attratti verso l'anodo positivo. Questa migrazione prepara il terreno per le reazioni chimiche.
Ossidazione e Riduzione: la chimica di base
Il cambiamento chimico effettivo avviene sulla superficie degli elettrodi. Queste reazioni sono note come reazioni "redox", abbreviazione di riduzione e ossidazione.
L'anodo: sede dell'ossidazione
L'anodo è definito come il sito dell'ossidazione. Qui, gli anioni che sono migrati verso l'elettrodo positivo cedono i loro elettroni in eccesso. Questa perdita di elettroni è la definizione di ossidazione.
Il catodo: sede della riduzione
Il catodo è definito come il sito della riduzione. I cationi attratti verso questo elettrodo negativo accettano elettroni dal circuito. Questo guadagno di elettroni è la definizione di riduzione, che spesso si traduce nella deposizione di un elemento neutro (come un metallo) sul catodo.
Comprendere la distinzione chiave: celle elettrolitiche vs. galvaniche
Un punto comune di confusione è la differenza tra una cella elettrolitica e una cella galvanica (come una normale batteria). Comprendere le loro funzioni opposte è fondamentale.
Consumo di energia vs. Produzione di energia
La differenza più importante è il flusso di energia. Una cella elettrolitica consuma energia per guidare una reazione non spontanea. Una cella galvanica rilascia energia da una reazione spontanea.
Polarità degli elettrodi
Questa differenza di funzione porta a una convenzione di segno opposta per gli elettrodi.
- In una cella elettrolitica, l'anodo è positivo e il catodo è negativo.
- In una cella galvanica, l'anodo è negativo e il catodo è positivo.
Ricorda che in entrambi i tipi di cella, l'ossidazione si verifica sempre all'anodo e la riduzione si verifica sempre al catodo. Ciò che cambia è la polarità.
Applicazioni comuni dell'elettrolisi
La capacità di forzare il cambiamento chimico con l'elettricità rende le celle elettrolitiche incredibilmente utili in molti settori.
Produzione industriale
L'elettrolisi è la pietra angolare dell'industria cloro-soda, che produce cloro gassoso e idrossido di sodio. È essenziale anche per la produzione di metalli puri come alluminio e rame dai loro minerali.
Energia pulita
Una delle applicazioni più promettenti è l'elettrolisi dell'acqua. Facendo passare una corrente attraverso l'acqua, questa può essere scissa nei suoi elementi costituenti: idrogeno e ossigeno. L'idrogeno risultante può essere utilizzato come combustibile pulito.
Finitura superficiale
La galvanostegia (o elettrodeposizione) è un processo comune in cui una cella elettrolitica viene utilizzata per depositare un sottile strato di un metallo (come oro o cromo) sulla superficie di un altro oggetto, che funge da catodo.
Fare la scelta giusta per il tuo obiettivo
Comprendere il principio dell'elettrolisi ti permette di applicarlo a obiettivi specifici.
- Se il tuo obiettivo principale è la produzione di materiali (es. idrogeno): Riconosci che la cella è uno strumento per scomporre composti stabili a bassa energia (come l'acqua) in prodotti ad alta energia e di valore (come il gas H₂).
- Se il tuo obiettivo principale è il rivestimento superficiale (galvanostegia): Comprendi che l'oggetto target deve essere il catodo, poiché è qui che gli ioni metallici positivi saranno ridotti e depositati come strato solido.
- Se il tuo obiettivo principale è l'elettrochimica fondamentale: Il punto cruciale più importante è che una cella elettrolitica utilizza energia esterna per invertire un processo chimico naturale, rendendola un potente motore per la sintesi.
Padroneggiando questi principi, puoi sfruttare l'elettrolisi come strumento potente e preciso per la trasformazione chimica.
Tabella riassuntiva:
| Componente | Funzione | Caratteristica chiave |
|---|---|---|
| Anodo | Sito di Ossidazione (perdita di elettroni) | Collegato al terminale positivo della fonte di alimentazione |
| Catodo | Sito di Riduzione (guadagno di elettroni) | Collegato al terminale negativo della fonte di alimentazione |
| Elettrolita | Fornisce il mezzo per il flusso di ioni | Un sale fuso o una soluzione ionica contenente ioni in movimento libero |
| Fonte di alimentazione | Guida la reazione non spontanea | Fornisce la tensione esterna richiesta per l'elettrolisi |
Pronto ad applicare i principi elettrochimici nel tuo laboratorio?
Sia che il tuo progetto riguardi la sintesi di materiali, la galvanostegia o lo sviluppo di soluzioni per l'energia pulita, avere l'attrezzatura giusta è fondamentale. KINTEK è specializzata nella fornitura di apparecchiature e materiali di consumo di alta qualità per supportare la tua ricerca e sviluppo elettrochimico.
Contattaci oggi stesso per discutere come le nostre soluzioni possono alimentare le tue innovazioni e fornire la precisione e l'affidabilità di cui il tuo laboratorio ha bisogno.
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
Domande frequenti
- Come dovrebbe essere mantenuto il corpo di una cella elettrolitica per garantirne la longevità? Estendi la vita utile della tua attrezzatura
- Di che materiale è costituita la cella elettrolitica a bagno d'acqua a cinque porte? Vetro borosilicato alto e PTFE spiegati
- Quale precauzione generale dovrebbe essere presa quando si maneggia la cella elettrolitica? Garantire risultati di laboratorio sicuri e accurati
- Come si deve far funzionare una cella elettrolitica a bagno d'acqua a cinque porte durante un esperimento? Padroneggiare il controllo preciso per risultati affidabili
- Come si può evitare la contaminazione durante gli esperimenti con la cella elettrolitica a bagno d'acqua a cinque porte? Padroneggia il Protocollo a 3 Pilastri



















