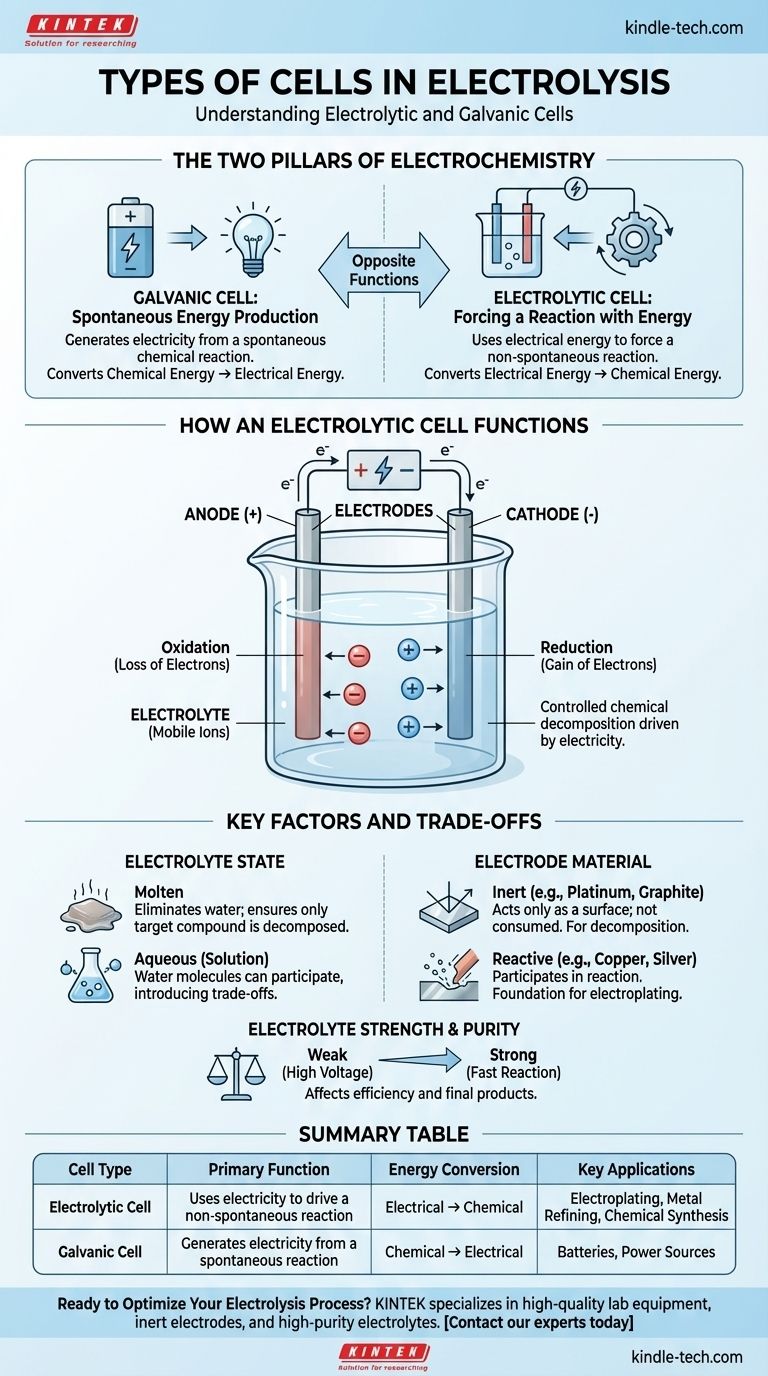
Alla sua base, l'elettrolisi avviene all'interno di un tipo specifico di cella elettrochimica nota come cella elettrolitica. Questa cella è uno dei due tipi fondamentali di celle elettrochimiche, l'altro è una cella galvanica. Una cella elettrolitica utilizza energia elettrica per forzare una reazione chimica non spontanea, mentre una cella galvanica fa l'opposto, generando elettricità da una reazione chimica spontanea.
La distinzione critica è lo scopo. Una cella galvanica (come una batteria) produce elettricità da una reazione chimica. Una cella elettrolitica usa l'elettricità per guidare una reazione chimica che non avverrebbe da sola.

I Due Pilastri dell'Elettrochimica
Per comprendere la cella utilizzata per l'elettrolisi, devi prima comprendere la sua controparte. Entrambi i tipi di celle sono fondamentali per l'elettrochimica, ma servono funzioni opposte.
La Cella Galvanica: Produzione Spontanea di Energia
Una cella galvanica è ciò che comunemente conosciamo come batteria. Sfrutta una reazione chimica spontanea che naturalmente tende a verificarsi.
Man mano che questa reazione procede, rilascia energia sotto forma di corrente elettrica. Converte direttamente l'energia chimica immagazzinata in energia elettrica.
La Cella Elettrolitica: Forzare una Reazione con l'Energia
Una cella elettrolitica è il motore dell'elettrolisi. È progettata per far avvenire una reazione chimica non spontanea fornendo energia esterna.
Si applica una corrente elettrica da una fonte esterna (come un alimentatore) alla cella. Questo forza la decomposizione di una sostanza, convertendo efficacemente l'energia elettrica in energia chimica creando nuove sostanze.
Come Funziona una Cella Elettrolitica
Il processo di elettrolisi è una decomposizione chimica controllata guidata dall'elettricità. Ciò richiede alcuni componenti chiave che lavorano in concerto.
I Componenti Principali
Una cella elettrolitica è composta da due elettrodi (un anodo positivo e un catodo negativo) immersi in un elettrolita. Una fonte di alimentazione esterna è collegata a questi elettrodi, creando un circuito.
Il Ruolo dell'Elettrolita
L'elettrolita è la sostanza che verrà scomposta. È tipicamente un composto ionico, sia allo stato fuso che disciolto in una soluzione (acquosa).
Questa sostanza deve contenere ioni mobili che sono liberi di muoversi e trasportare una carica. Gli elettroliti sono generalmente soluzioni di acidi, basi o sali.
La Funzione degli Elettrodi
Gli elettrodi sono i conduttori attraverso i quali l'elettricità entra ed esce dall'elettrolita.
- Anodo: L'elettrodo positivo. Attira gli ioni negativi (anioni), dove avviene l'ossidazione (perdita di elettroni).
- Catodo: L'elettrodo negativo. Attira gli ioni positivi (cationi), dove avviene la riduzione (guadagno di elettroni).
La fonte di alimentazione esterna è ciò che mantiene questa separazione di carica e guida l'intero processo.
Comprendere i Fattori Chiave e i Compromessi
L'esito dell'elettrolisi non è automatico. I prodotti specifici che crei dipendono interamente dai materiali e dalle condizioni che scegli.
Stato dell'Elettrolita: Fuso vs. Acquoso
Lo stato dell'elettrolita è una decisione critica. Se si utilizza una soluzione acquosa (disciolta in acqua), le molecole d'acqua stesse possono partecipare alla reazione.
Questo introduce un compromesso, poiché l'elettricità può scindere l'acqua invece del composto disciolto, a seconda di quale reazione sia più facile da guidare. L'uso di un elettrolita fuso elimina l'acqua dall'equazione, garantendo che solo il composto target venga decomposto.
Materiale dell'Elettrodo: Inerte vs. Reattivo
Gli elettrodi possono essere partecipanti passivi o attivi nella reazione.
- Elettrodi Inerti (es. Platino, Grafite): Questi agiscono solo come superficie per la reazione. Non vengono consumati e sono usati quando si vuole decomporre l'elettrolita stesso, come quando si scinde l'acqua in idrogeno e ossigeno.
- Elettrodi Reattivi (es. Rame, Argento): Questi possono dissolversi o partecipare alla reazione chimica. Questo è il principio alla base dell'elettrodeposizione, dove l'anodo si dissolve e i suoi ioni metallici vengono depositati sull'oggetto al catodo.
Forza e Purezza dell'Elettrolita
L'efficienza dell'elettrolisi è influenzata anche dall'elettrolita. Gli elettroliti forti, che si dissociano completamente in ioni, conducono bene l'elettricità e consentono una reazione più rapida.
Gli elettroliti deboli richiedono più energia (una tensione più alta) per avviare e sostenere la reazione. La presenza di altri agenti ossidanti o riducenti nell'elettrolita può anche alterare i prodotti finali.
Applicare Questo al Tuo Obiettivo
Comprendere la funzione di una cella elettrolitica consente di controllare le reazioni chimiche per scopi industriali e scientifici specifici.
- Se il tuo obiettivo principale è produrre una sostanza pura: Seleziona un elettrodo inerte e un elettrolita ad alta purezza (fuso o acquoso) per assicurarti di decomporre il composto target, come nella produzione di alluminio dal minerale di bauxite.
- Se il tuo obiettivo principale è rivestire o purificare un metallo: Utilizza un anodo reattivo fatto del materiale di rivestimento e un elettrolita contenente ioni di quello stesso metallo. Questa è la base dell'elettrodeposizione e dell'elettroaffinazione.
- Se il tuo obiettivo principale è generare elettricità: Hai bisogno di una cella galvanica, non elettrolitica, poiché la sua funzione è rilasciare energia da una reazione spontanea.
In definitiva, l'elettrolisi fornisce un metodo potente per utilizzare l'energia elettrica per controllare e guidare con precisione il cambiamento chimico.
Tabella Riepilogativa:
| Tipo di Cella | Funzione Primaria | Conversione di Energia | Applicazioni Chiave |
|---|---|---|---|
| Cella Elettrolitica | Utilizza l'elettricità per guidare una reazione non spontanea | Elettrica → Chimica | Elettrodeposizione, Raffinazione dei Metalli, Sintesi Chimica |
| Cella Galvanica | Genera elettricità da una reazione spontanea | Chimica → Elettrica | Batterie, Fonti di Alimentazione |
Pronto a Ottimizzare il Tuo Processo di Elettrolisi?
Comprendere il giusto tipo di cella e i suoi componenti è fondamentale per un'elettrodeposizione, una raffinazione dei metalli o una sintesi chimica efficiente. KINTEK è specializzata nella fornitura di attrezzature e materiali di consumo da laboratorio di alta qualità, inclusi elettrodi inerti ed elettroliti ad alta purezza, per garantire che i tuoi processi elettrolitici siano precisi ed efficaci.
Contatta i nostri esperti oggi per discutere la tua applicazione specifica e scoprire come le nostre soluzioni possono migliorare le capacità e i risultati del tuo laboratorio.
Guida Visiva
Prodotti correlati
- Cella Elettrolitica Elettrochimica a Cinque Porte
- Cella Elettrochimica Elettrolitica al Quarzo per Esperimenti Elettrochimici
- Cella Elettrolitica Ottica Elettrochimica H-Type a Doppio Strato con Bagno d'Acqua
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Cella Elettrolitica in PTFE Cella Elettrochimica Resistente alla Corrosione Sigillata e Non Sigillata
Domande frequenti
- Perché sono necessari i sistemi di lucidatura ed incisione elettrolitica da laboratorio? Rivelare la Microstruttura dell'Acciaio Inossidabile
- Quali sono le caratteristiche chiave di una cella elettrolitica a bagno d'acqua a doppio strato? Ottieni un controllo preciso della temperatura per i tuoi esperimenti
- Come devono essere maneggiati i componenti in vetro di una cella elettrolitica? Una guida per un uso sicuro ed efficace
- Quale ruolo svolgono le ceramiche porose di zirconia in una cella elettrochimica a fluido supercritico? Garantire l'integrità dei dati.
- Come funzionano i componenti di una cella elettrochimica standard a tre elettrodi durante i test HEA?
- Quali sono i rischi di un controllo improprio della tensione in una cella elettrolitica? Evitare danni costosi e inefficienze
- Come deve essere pulita la cella elettrolitica di tipo H dopo l'uso? Manutenzione esperta per risultati elettrochimici puri
- Quali controlli regolari sono necessari per la manutenzione della cella elettrolitica di tipo H? Garantire la precisione sperimentale



















