Definizione e funzioni di base della cella elettrolitica
Indice dei contenuti
Comprendere il ruolo dell'energia elettrica e dell'energia chimica in una cella elettrolitica
Cella elettrochimica Una cella elettrochimica è un dispositivo in grado di generare energia elettrica da reazioni chimiche o di facilitare le reazioni chimiche attraverso l'introduzione di energia elettrica.
Definizione di elettrochimica L'elettrochimica è lo studio dei processi chimici che causano il movimento degli elettroni. Si occupa dell'interazione tra energia elettrica e cambiamento chimico.
Esempio: Lo studio delle cellule elettrochimiche rientra nell'elettrochimica. Si occupa delle cellule che convertono l'energia chimica in energia elettrica.
Importanza dell'elettrochimica L'elettrochimica si occupa delle relazioni tra fenomeni elettrici e chimici. I processi elettrochimici sono utilizzati in vari settori dell'industria. È il processo più importante per la produzione di diversi prodotti chimici. La produzione di vari metalli si basa sul metodo elettrochimico. L'idrogeno è prodotto dall'elettrolisi dell'acqua. L'elettrolisi svolge un ruolo importante nello sviluppo dell'automobile elettrica.
Descrizione dei componenti di una cella elettrolitica, compresi gli elettrodi e l'elettrolita
Le celle elettrolitiche sono costituite da 3 componenti essenziali.

L'anodo è l'elettrodo negativo o riducente che rilascia elettroni al circuito esterno e si ossida durante una reazione elettrochimica.
Il catodo è l'elettrodo positivo o ossidante che acquisisce elettroni dal circuito esterno e si riduce durante la reazione elettrochimica.
L'elettrolita è il mezzo che fornisce il meccanismo di trasporto degli ioni tra il catodo e l'anodo di una cella. Gli elettroliti sono spesso considerati liquidi, come l'acqua o altri solventi, con sali disciolti, acidi o alcali, necessari per la conduzione ionica. Va tuttavia notato che molte batterie, comprese quelle convenzionali (AA/AAA/D), contengono elettroliti solidi che agiscono come conduttori ionici a temperatura ambiente.
Considerazioni sulla scelta di catodo, anodo ed elettrolita
Le proprietà desiderabili per i materiali dell'anodo, del catodo e dell'elettrolita sono indicate di seguito.
Spiegazione del processo di trasferimento di carica tra elettrodi e ioni
cella elettrolitica, qualsiasi dispositivo in cui l'energia elettrica viene convertita in energia chimica o viceversa. Una cella di questo tipo è tipicamente costituita da due conduttori metallici o elettronici (elettrodi) tenuti separati l'uno dall'altro e in contatto con un elettrolita (q.v.), di solito un composto ionico disciolto o fuso. Il collegamento degli elettrodi a una fonte di corrente elettrica continua rende uno di essi carico negativamente e l'altro positivamente. Gli ioni positivi dell'elettrolita migrano verso l'elettrodo negativo (catodo) e lì si combinano con uno o più elettroni, perdendo parte o tutta la loro carica e diventando nuovi ioni con carica inferiore o atomi o molecole neutre; allo stesso tempo, gli ioni negativi migrano verso l'elettrodo positivo (anodo) e vi trasferiscono uno o più elettroni, diventando anch'essi nuovi ioni o particelle neutre. L'effetto complessivo dei due processi è il trasferimento di elettroni dagli ioni negativi agli ioni positivi, una reazione chimica (vedi reazione di ossidoriduzione). Un esempio è l'elettrolisi del cloruro di sodio (sale comune), che forma sodio metallico e cloro gassoso; l'energia necessaria per far procedere la reazione è fornita dalla corrente elettrica. Altre applicazioni comuni dell'elettrolisi sono l'elettrodeposizione per la raffinazione o la placcatura dei metalli e la produzione di soda caustica.
Che cos'è una cella elettrolitica? Una cella elettrolitica può essere definita come un dispositivo elettrochimico che utilizza l'energia elettrica per facilitare una reazione redox non spontanea. Le celle elettrolitiche sono celle elettrochimiche che possono essere utilizzate per l'elettrolisi di alcuni composti. Ad esempio, l'acqua può essere sottoposta a elettrolisi (con l'aiuto di una cella elettrolitica) per formare ossigeno gassoso e idrogeno gassoso. Ciò avviene sfruttando il flusso di elettroni (nell'ambiente di reazione) per superare la barriera dell'energia di attivazione della reazione redox non spontanea.


I tre componenti principali delle celle elettrolitiche sono: Catodo (carico negativamente per le celle elettrolitiche) Anodo (carico positivamente per le celle elettrolitiche) Elettrolita L'elettrolita fornisce il mezzo per lo scambio di elettroni tra il catodo e l'anodo. Gli elettroliti comunemente utilizzati nelle celle elettrolitiche sono l'acqua (contenente ioni disciolti) e il cloruro di sodio fuso.
CELLE ELETTROLITTICHE Per definire le celle elettrolitiche, occorre innanzitutto comprendere l'elettrolisi. L'elettrolisi è un metodo che consiste nel far passare una corrente elettrica attraverso un liquido contenente ioni, provocando la disintegrazione dei composti al suo interno. Questo metodo viene utilizzato per isolare il metallo dagli elementi metallici, per separare altre sostanze chimiche (come l'acqua), per galvanizzare i metalli e per ricaricare le batterie. Un circuito completo è essenziale per mantenere un processo elettrolitico; dobbiamo essere in grado di prelevare continuamente elettricità dalla cella.
Il catodo e l'anodo di una cella elettrolitica sono collegati a una fonte di energia. Questi due elettrodi stabili e una soluzione elettrolitica fluida sono presenti in ogni cella elettrolitica. La soluzione elettrolitica conduce l'elettricità poiché gli ioni disciolti possono muoversi liberamente nella soluzione.
La cella elettrolitica e i suoi componenti La cella elettrolitica è costituita da tre componenti principali: batteria, elettrodi ed elettrolita. Batteria La batteria funge da fonte di energia. Fornisce l'energia elettrica per provocare il cambiamento chimico, cioè la decomposizione del composto ionico. Elettrodi Gli elettrodi sono contatti elettrici che chiudono o completano il circuito elettrico tra i fili e l'elettrolita. Esempi di elettrodi sono le barre di carbonio (grafite) e le piastre metalliche. L'elettrodo a sinistra (vedi immagine precedente), collegato al polo positivo della batteria, è l'elettrodo positivo o anodo. L'elettrodo a destra, collegato al terminale negativo della batteria, è l'elettrodo negativo o catodo. Elettrolita L'elettrolita è una sostanza che contiene ioni mobili quando è fusa o in soluzione acquosa, per condurre l'elettricità. Esempi di elettroliti sono il cloruro di sodio fuso, la soluzione di solfato di rame (II) e gli acidi, come l'acido cloridrico diluito. Esempi di non-elettroliti sono la soluzione di zucchero, l'etanolo, lo zolfo (fuso), in quanto si tratta di liquidi o soluzioni che non contengono ioni mobili per condurre l'elettricità.

Applicazioni Le celle elettrolitiche sono spesso utilizzate per decomporre i composti chimici, in un processo chiamato elettrolisi, dove elettro significa elettricità e la parola greca lisi significa disgregare. Esempi importanti di elettrolisi sono la decomposizione dell'acqua in idrogeno e ossigeno e della bauxite in alluminio e altre sostanze chimiche. L'elettrodeposizione (ad esempio, di rame, argento, nichel o cromo) viene effettuata utilizzando una cella elettrolitica. L'elettrolisi è una tecnica che utilizza una corrente elettrica continua (DC).
A livello commerciale, le celle elettrolitiche sono utilizzate per l'elettroraffinazione e l'elettrofiltrazione di diversi metalli non ferrosi. La maggior parte dell'alluminio, del rame, dello zinco e del piombo di elevata purezza viene prodotta industrialmente in celle elettrolitiche.
Una cella elettrolitica I tre componenti delle celle elettrolitiche sono un elettrolita e due elettrodi.
Elettroliti Gli elettroliti sono le sostanze che danno una soluzione elettricamente conduttiva quando sono disciolte in solventi polari, come l'acqua. Infatti, quando l'elettrolita si scioglie nei solventi polari, si scompone in cationi e anioni e si distribuisce uniformemente nella soluzione. Questi cationi e anioni, sottoposti a un potenziale elettrico nella soluzione, si muovono verso l'elettrodo con un'abbondanza di elettroni e un deficit di elettroni, rispettivamente. Questo movimento di cationi e anioni in direzione opposta genera corrente e forma le celle elettrolitiche.
Mentre i sali, gli acidi e le basi formano un elettrolita, anche alcuni gas, in determinate condizioni, possono comportarsi come un elettrolita, come il cloruro di idrogeno ad alta temperatura e bassa pressione.
Reazioni chimiche nella cella elettrolitica
Spiegazione della reazione di ossidoriduzione in una cella elettrolitica
Nelle celle elettrochimiche avvengono reazioni di ossidoriduzione (redox). Esistono due tipi di celle elettrochimiche: le celle galvaniche (voltaiche), in cui avvengono reazioni spontanee, e le celle elettrolitiche, in cui avvengono reazioni non spontanee.
Entrambi i tipi di celle hanno elettrodi dove avvengono le reazioni di ossidazione e riduzione. L'ossidazione avviene sull'elettrodo chiamato anodo e la riduzione sull'elettrodo chiamato catodo.
In una cella elettrolitica, l'anodo è positivo e il catodo è negativo. Questo perché l'anodo attira gli anioni dalla soluzione. In una cella galvanica, invece, l'anodo è carico negativamente, poiché l'ossidazione spontanea all'anodo è la fonte degli elettroni o della carica negativa della cella. Il catodo di una cella galvanica è il suo terminale positivo.
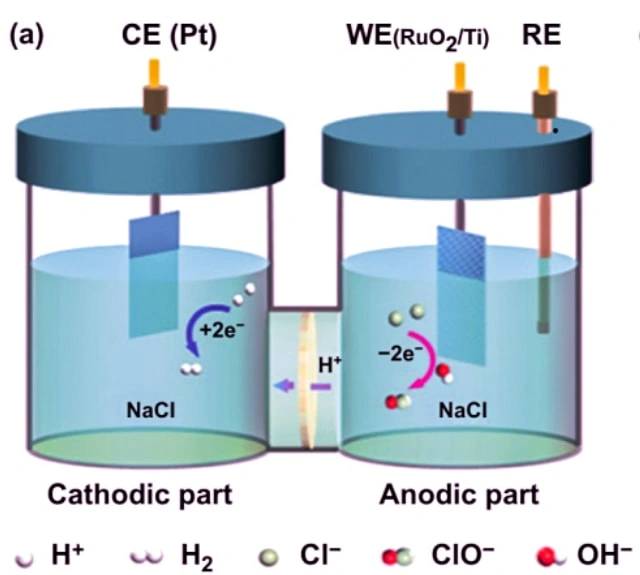
Esempio di elettrolisi del cloruro di sodio
Un esempio di cella elettrolitica è l'elettrolisi del cloruro di sodio. Quando il cloruro di sodio viene sciolto in acqua e sottoposto a elettrolisi, si verificano le seguenti reazioni:
Al catodo: 2 H2O + 2 e- -> 2 OH- + H2
All'anodo: 2 Cl- -> Cl2 + 2 e-
Reazione complessiva: 2 NaCl + 2 H2O -> 2 Na + Cl2 + H2 + 2 OH-
In questa cella elettrolitica, due elettrodi inerti sono immersi in cloruro di sodio fuso. Quando una corrente elettrica attraversa il circuito, il catodo si arricchisce di elettroni e sviluppa una carica negativa. Gli ioni di sodio, carichi positivamente, vengono attratti dal catodo, dando luogo alla formazione di sodio metallico. Allo stesso tempo, gli atomi di cloro sono attratti dall'anodo con carica positiva, portando alla formazione di cloro gassoso. Il risultato complessivo è la produzione di sodio metallico, cloro gassoso e idrossido di sodio acquoso.
Applicazioni delle celle elettrolitiche
Le celle elettrolitiche hanno diverse applicazioni:
- Produzione di ossigeno e idrogeno dall'acqua.
- Estrazione di alluminio dalla bauxite.
- Elettrodeposizione, che prevede la formazione di un sottile strato protettivo di un metallo specifico sulla superficie di un altro metallo.
- Elettroraffinazione di metalli non ferrosi.
- Processi di recupero elettrolitico.
- La produzione industriale di rame di elevata purezza, zinco di elevata purezza e alluminio di elevata purezza avviene quasi sempre attraverso celle elettrolitiche.
![Schema della cella elettrolitica con catodo HER e anodo ClER]()
Applicazione delle celle elettrolitiche (zinco di elevata purezza, alluminio di elevata purezza, rame di elevata purezza)
Le celle elettrolitiche svolgono un ruolo cruciale in diversi settori e processi, consentendo la produzione di importanti sostanze chimiche e materiali.
Applicazioni dell'elettrolisi
Uso dell'elettrolisi nell'elettrodeposizione per la raffinazione o la placcatura dei metalli
L'elettrolisi è ampiamente utilizzata nel processo di elettrodeposizione per la raffinazione o la placcatura dei metalli. Un'applicazione pratica dell'elettrolisi in questo contesto è l'elettrodeposizione. Nell'elettropulizia, l'articolo da pulire, come lo zinco o l'alluminio, è il catodo e una forte corrente viene fatta passare attraverso una soluzione elettrolitica. Al catodo si producono soda caustica e idrogeno, che rimuovono efficacemente il grasso e le impurità dalla superficie dell'articolo. Questo processo può essere utilizzato per raffinare o placcare i metalli, dare un aspetto pulito e brillante, proteggere dalla corrosione e sostituire i materiali usurati.
Produzione di soda caustica attraverso l'elettrolisi
Un'altra importante applicazione dell'elettrolisi è la produzione di sostanze chimiche, tra cui la soda caustica (NaOH) e il cloro gassoso, su larga scala. In questo processo, l'elettrolisi viene utilizzata per scomporre il cloruro di sodio (NaCl) nei suoi elementi costitutivi, sodio (Na) e cloro (Cl2). La reazione al catodo comporta la riduzione degli ioni sodio (Na+) a sodio metallico (Na), mentre all'anodo gli ioni cloruro (Cl-) vengono ossidati per formare cloro gassoso (Cl2). La reazione complessiva della cella è 2NaCl → 2Na + Cl2. Attraverso questo processo elettrolitico è possibile produrre grandi quantità di soda caustica e cloro gassoso per varie applicazioni industriali.
L'elettrolisi nell'estrazione dei metalli
L'elettrolisi svolge un ruolo fondamentale nell'estrazione dei metalli dai loro minerali. Esistono due metodi principali di estrazione dei metalli mediante elettrolisi. Nel primo metodo, il minerale viene trattato con un acido forte per ottenere un sale e la soluzione salina risultante viene elettrolizzata per liberare il metallo. Nel secondo metodo, il minerale è allo stato fuso e viene elettrolizzato direttamente in un forno.
Un esempio di estrazione del metallo mediante elettrolisi è l'estrazione dello zinco. Il minerale di zinco viene trattato con acido solforico per formare una soluzione di solfato di zinco, che viene poi elettrolizzata. Nel serbatoio elettrolitico si utilizzano catodi di alluminio e anodi di piombo. Lo zinco si deposita sui catodi, mentre l'acido solforico viene rigenerato sugli anodi. Questo processo elettrolitico consente di estrarre zinco di elevata purezza.

zinco e alluminio
In generale, l'elettrolisi trova applicazioni pratiche in diverse industrie per l'estrazione, la raffinazione e la placcatura dei metalli, nonché per la produzione di sostanze chimiche come la soda caustica. Sfruttando la potenza dell'elettrolisi, le aziende possono ottenere risultati di alta qualità e soddisfare le esigenze dei rispettivi settori.
Conversione dell'energia chimica in elettricità
Spiegazione della generazione di energia nelle reazioni che coinvolgono sostanze che generano energia
Nelle celle elettrochimiche, l'energia chimica viene convertita in energia elettrica attraverso un processo chiamato elettrolisi. L'elettrolisi è una reazione redox che si verifica in una cella elettrochimica, dove le sostanze chimiche vengono decomposte agli elettrodi. I prodotti dell'elettrolisi dipendono dal tipo di elettrodo e di elettrolita utilizzati nella cella. Questo processo è alla base di diverse applicazioni dell'elettrochimica.
Il campo dell'elettrochimica comprende la produzione di elettricità dall'energia rilasciata durante le reazioni chimiche spontanee, nonché l'uso dell'energia elettrica per guidare cambiamenti chimici non spontanei. Le reazioni redox, che comportano il trasferimento di elettroni tra specie, sono al centro di questi processi. Molte reazioni chimiche e biologiche sono reazioni redox e svolgono un ruolo cruciale nell'ottenere energia per scopi domestici, di trasporto o industriali.
L'energia generata da queste reazioni viene utilizzata in un'ampia gamma di applicazioni, tra cui la combustione di combustibile per la digestione del cibo negli animali, i processi industriali, la fotosintesi, l'estrazione di metalli dai minerali, la produzione di importanti sostanze chimiche e il funzionamento di batterie e celle a combustibile.
Esempio di batteria di accumulo al piombo-acido

Batterie al piombo-acido
La batteria al piombo funziona sia come una cella elettrolitica che come una cella galvanica. Quando si scarica, agisce come una cella galvanica, convertendo l'energia chimica in energia elettrica. Durante il processo di scarica, il biossido di piombo, il piombo metallico e l'acido solforico reagiscono per formare solfato di piombo e acqua. L'ossidazione del piombo a solfato di piombo avviene su un elettrodo, mentre la riduzione del biossido di piombo a solfato di piombo avviene sull'altro elettrodo. La carica elettrica viene trasportata attraverso l'elettrolita dalla migrazione degli ioni di idrogeno.
Questa separazione dei processi di ossidazione e riduzione crea una forza motrice, o una tensione, che fa fluire l'elettricità attraverso un circuito esterno che collega i due elettrodi. Nelle celle e nelle batterie sono state utilizzate molte altre combinazioni chimiche, ognuna con reazioni e caratteristiche specifiche.
Celle a combustibile
Le celle a combustibile sono un altro tipo di cella elettrochimica che converte l'energia chimica del combustibile in elettricità. Queste celle funzionano attraverso una reazione elettrochimica tra l'idrogeno combustibile e un agente ossidante, in genere l'ossigeno. A differenza delle batterie, che generano energia da sostanze chimiche già presenti al loro interno, le celle a combustibile richiedono un flusso continuo di ossigeno e una fornitura di combustibile per generare elettricità.

La cella a combustibile
In sintesi, la conversione dell'energia chimica in elettricità è un processo fondamentale dell'elettrochimica. Avviene attraverso reazioni redox in celle elettrochimiche, come le batterie al piombo e le celle a combustibile. Queste tecnologie hanno diverse applicazioni, dall'alimentazione dei veicoli alla generazione di elettricità per l'esplorazione dello spazio.
Celle alternative per la generazione di elettricità
- Conoscere le celle solari e il ruolo dei semiconduttori e dell'assorbimento della luce
- Il silicio amorfo (A-Si) è un materiale fotovoltaico a film sottile dominante, con una capacità di assorbimento della luce circa 40 volte superiore a quella del silicio cristallino.
- Il tellururo di cadmio (CdTe) è un altro materiale a film sottile con un'elevata capacità di assorbimento della luce. Può assorbire il 90% dello spettro solare con un film sottile di appena 1 mm.

Silicio amorfo, tellururo di cadmio, diseleniuro di rame-indio
- Spiegazione delle celle a combustibile e del loro uso di agenti ossidanti e riducenti
- Le celle a combustibile sono celle elettrochimiche che fanno reagire l'idrogeno combustibile con l'ossigeno o un altro agente ossidante per convertire l'energia chimica in elettricità.
- Sono diverse dalle batterie perché richiedono una fonte continua di combustibile e ossigeno per sostenere la reazione chimica.
- Le celle a combustibile sono in grado di produrre elettricità in modo continuo, finché vengono forniti combustibile e ossigeno.
- Sono utilizzate per l'alimentazione primaria e di riserva in varie applicazioni, tra cui edifici commerciali, industriali, residenziali e aree remote.
- Le celle a combustibile sono utilizzate anche per alimentare veicoli a celle a combustibile come carrelli elevatori, automobili, autobus, barche, motociclette e sottomarini.
Si prevede che il mercato globale delle celle a combustibile aumenterà del 19,9% entro il 2030.
- Altre celle per la generazione di elettricità
- Le celle solari generano elettricità attraverso l'assorbimento della luce da parte dei semiconduttori.
- Le celle a combustibile utilizzano l'energia chimica del combustibile per generare elettricità.
- Le celle ricaricabili possono essere utilizzate più volte ricaricandole.
- Le celle non ricaricabili non possono essere riutilizzate e devono essere smaltite.
- Le batterie di accumulo al piombo/acido sono celle secondarie utilizzate come fonte di energia nei veicoli.
Le celle a film sottile, come le celle solari a film sottile, i transistor a film sottile e le batterie a film sottile, offrono una migliore efficienza, una ricarica più rapida e una durata maggiore rispetto alle celle convenzionali.
Il campo delle celle alternative per la generazione di elettricità è in continua evoluzione. I ricercatori continuano a migliorare l'efficienza e le proprietà dei materiali a film sottile, mentre gli esperti del settore lavorano per ridurre i costi e aumentare la produzione.Se siete interessati a questo prodotto, potete consultare il nostro sito web aziendale:https://kindle-tech.com/products/h-type-electrolytic-cell-h-type-triple
Prodotti correlati
- Cella Elettrolitica Tipo H Tripla Elettrochimica
- Cella Elettrochimica Elettrolitica per la Valutazione dei Rivestimenti
- Cella Elettrochimica per Elettrolisi Spettrale a Strato Sottile
- Bagno d'acqua per cella elettrochimica elettrolitica multifunzionale a strato singolo e doppio
- Elettrodo a foglio di platino per applicazioni di laboratorio e industriali
Articoli correlati
- Applicazioni delle celle elettrolitiche nella purificazione e nella galvanotecnica
- Superare le sfide del funzionamento delle celle elettrolitiche di tipo H
- La Variabile Invisibile: Padroneggiare l'Ispezione della Cella Elettrolitica
- Capire gli elettrodi e le celle elettrochimiche
- Applicazioni della cella elettrolitica di tipo H nell'estrazione dei metalli

















